Inloggen
Welkom op FTO
Log eenvoudig in met uw Medi-Access account
Nog geen account? Nu aanmelden
Wachtwoord vergeten?Astma is een veelvoorkomende chronische longziekte met belangrijke implicaties voor de patiënt. De herkenning en behandeling worden bemoeilijkt doordat de ziekte zich op verschillende manieren kan presenteren en er verschillende onderliggende mechanismen een rol kunnen spelen. Daarnaast zijn er allerlei prikkels die een toename van astmaklachten uit kunnen lokken. Luchtweginfecties vormen één van de belangrijkste prikkels en komen veelvuldig voor bij patiënten met astma.
In deze FTO-Online publicatie gaan dr. Pieter-Paul Hekking (longarts) en drs. Marieke Römkens (kaderarts astma/COPD) in op de pathofysiologie, diagnostiek en behandeling van astma. Daarbij is speciale aandacht voor de relatie met luchtweginfecties. Behandeling van astma volgens het stappenplan van de NHG-standaard wordt geïllustreerd aan de hand van een interessante casus.
Astma wordt gekenmerkt door reversibele obstructie van de luchtwegen en een verhoogde gevoeligheid voor bepaalde prikkels (bronchiale hyperreactiviteit). Patiënten met astma kunnen last hebben van kortademigheid, benauwdheid, een piepende ademhaling, hoesten of druk op de borst. Deze klachten treden aanvalsgewijs op en worden veroorzaakt door reactie op een allergische of niet-allergische prikkel. De herkenning en behandeling van astma worden bemoeilijkt doordat de ziekte zich op verschillende manieren kan presenteren en er verschillende onderliggende mechanismen een rol kunnen spelen.
De prevalentie van astma werd in Nederland in 2021 geschat op 1,8 miljoen (102/1000 personen). In datzelfde jaar werden ruim 500.000 patiënten met astma actief behandeld in de eerste of in de tweede lijn (25,6/1000 mannen en 33,4/1000 vrouwen).1
Astma ontstaat vaak op jonge leeftijd, maar kan ook ontstaan op volwassen leeftijd. De incidentiecijfers dalen dan ook met de leeftijd: van gemiddeld 39,5/1000 personen in de leeftijdscategorie tussen drie en zeven jaar naar 4,1/1000 personen op volwassen leeftijd.2 In de basisschoolleeftijd komt astma ongeveer twee keer zo vaak voor bij jongens als bij meisjes.3 Rond de puberteit verandert dat en komt astma vaker voor bij meisjes dan bij jongens.4 Ook op volwassen leeftijd hebben vrouwen vaker astmaklachten dan mannen. Met name ernstig astma komt bij vrouwen meer voor.5
Astma is een heterogene ziekte die zich met verschillende klachten kan presenteren. Daarnaast zijn er verschillende onderliggende mechanismen die deze klachten veroorzaken. Deze verschillende vormen van astma worden wel fenotypes genoemd (figuur 1). De belangrijkste discriminerende factoren, die de fenotypes bepalen, zijn:6
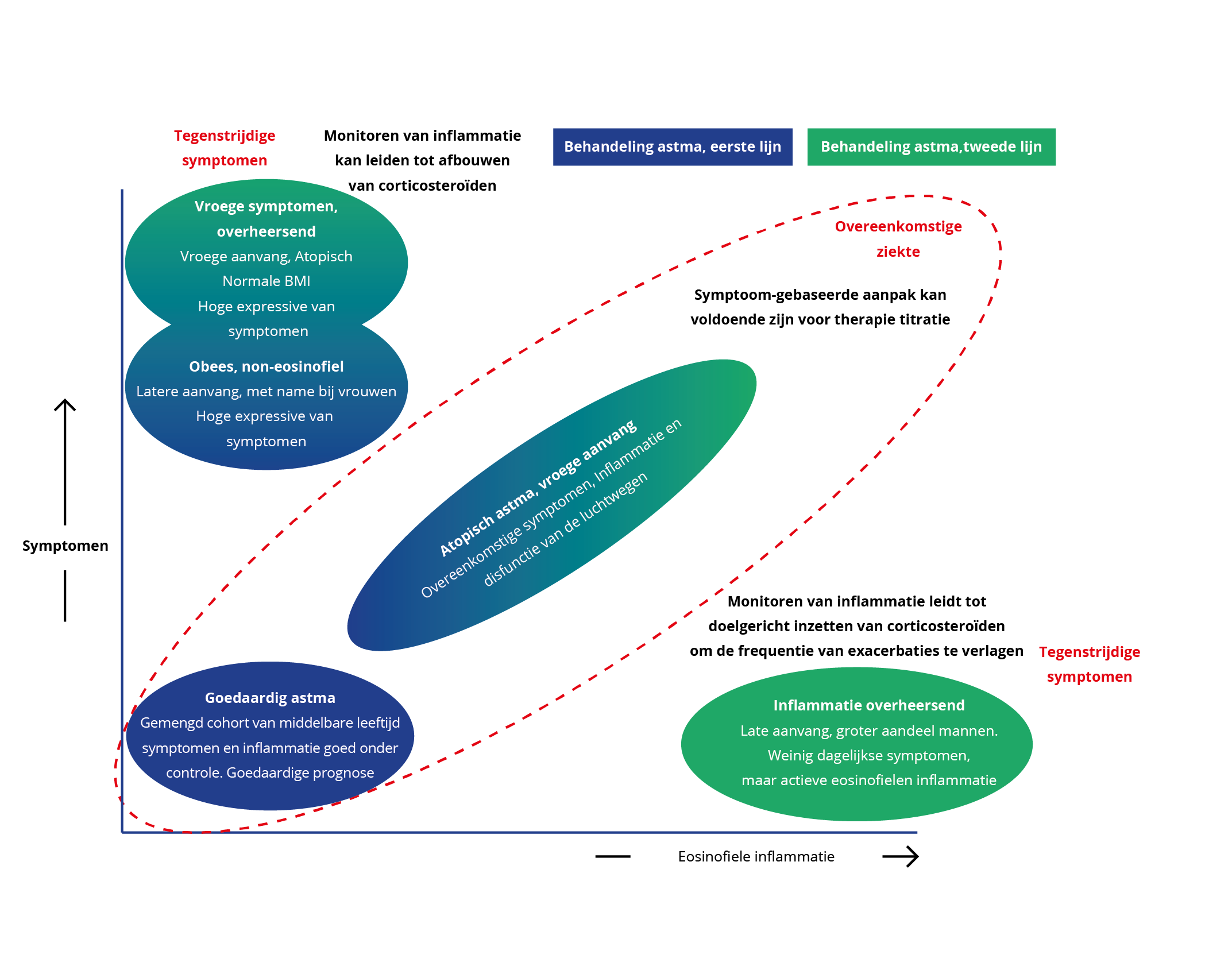
Figuur 1 Verschillende fenotypes bij astma.
Bron, Gebaseerd op: Haldar, 20086
Bij patiënten in de eerste lijn komt allergisch astma veruit het meest voor. Over het algemeen is deze vorm van astma sinds de kinderleeftijd aanwezig. De luchtwegen van patiënten met allergisch astma reageren meestal op inhalatie-allergenen zoals bijvoorbeeld huisstofmijt, huisdieren, schimmels en pollen. Voedselallergieën kunnen ook een rol spelen bij allergisch astma, waarbij gedacht kan worden aan melk-, soja-, pinda- of notenallergie. Deze reactie is over het algemeen IgE gemedieerd en kan luchtweginflammatie veroorzaken, wat weer kan leiden tot bronchiale hyperreactiviteit. Bij de ontwikkeling van allergisch astma spelen genetische factoren en atopie een belangrijke rol.2
Niet-allergisch astma is gekenmerkt door bronchiale hyperreactiviteit op niet-allergische prikkels. Deze vorm van astma manifesteert zich vaak voor het eerst op volwassen leeftijd. Belangrijke prikkels zijn onder andere virale luchtweginfecties, (tabaks)rook, fijnstof, lichamelijke inspanning, kou, stress en het gebruik van bepaalde geneesmiddelen (acetylsalicylzuur en NSAID’s).2
De pathofysiologie van astma is een complexe samenwerking van verschillende immunologische cellen en cytokines. Bij een groot deel van de patiënten met astma spelen actieve dendritische cellen (DC’s) in eerste instantie een rol. DC’s kunnen allergische en niet-allergische prikkels herkennen, zich hieraan binden en het vervolgens presenteren aan T-helper 2 cellen (Th2-cellen) van het immuunsysteem. Th2-cellen stimuleren de productie van verschillende cytokines, waaronder Interleukine 4 (IL-4), IL-5 en IL-13. IL-4 en IL-13 zijn beide betrokken bij de aanmaak van plasmacellen. Plasmacellen zijn op hun beurt verantwoordelijk voor de productie van IgE. De concentratie IgE in de luchtwegen neemt hierdoor toe. Mestcellen vormen een complex met IgE en dat leidt tot de productie van histamine, prostaglandinen en leukotriënen. Daarnaast activeert IL-5 de aanmaak van eosinofielen in het beenmerg. Deze eosinofielen verplaatsen zich naar de luchtwegen en produceren verschillende proteasen en leukotriënen.
Een overzicht van de pathofysiologie bij allergisch astma wordt weergegeven in figuur 2.7

Figuur 2 Overzicht van de pathofysiologie bij allergisch astma.
Bron, Gebaseerd op: Maspero, 20227
De productie van histamine, leukotriënen en prostaglandinen in de luchtwegen heeft verschillende gevolgen (figuur 3):8
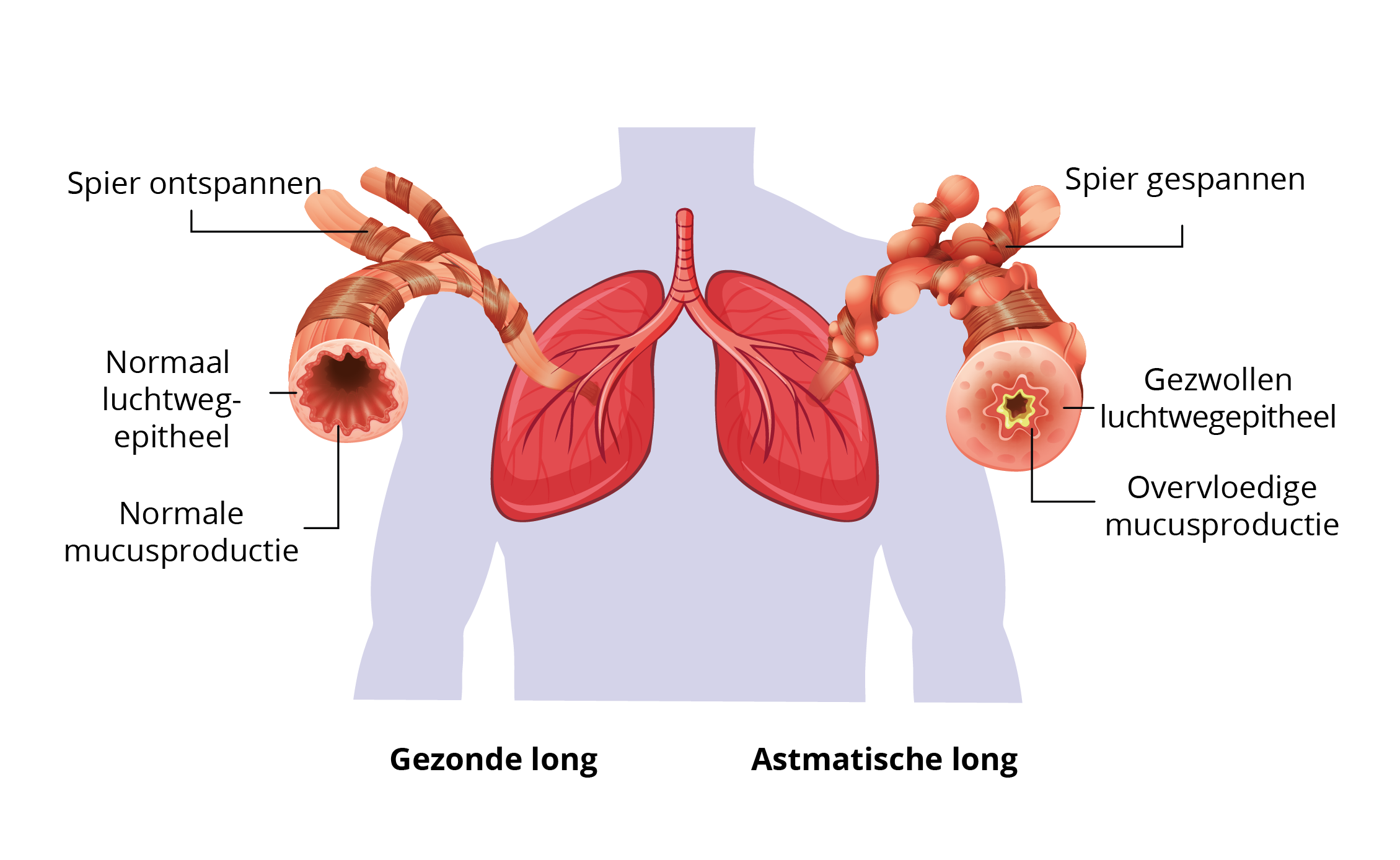
Figuur 3 Gezonde longen vergeleken met astmatische longen.
Bij een deel van de astmapatiënten zijn geen kenmerken te vinden van type 2 inflammatie. Hierbij worden de klachten en de luchtwegobstructie voornamelijk veroorzaakt door de type 1 T-helpercel en de type 17 T-helpercel. Deze processen zijn vaak geïnitieerd en in stand gehouden door recidiverende bacteriële infecties.
Een belangrijk kenmerk van astma is reversibiliteit. Bij afwezigheid van prikkels en/of bij een passende behandeling, zullen de klachten verdwijnen en kunnen de luchtwegen volledig herstellen. Bij ongecontroleerde astma kunnen de luchtwegen permanent beschadigd raken door remodeling, verlittekening of verdikking van de basaalmembraan.
Het is algemeen bekend dat luchtweginfecties een longaanval kunnen veroorzaken (zie ook het hoofdstuk ‘Monitoring’), maar er zijn ook steeds meer aanwijzingen dat astmatische patiënten gevoeliger zijn voor luchtweginfecties dan mensen zonder astma. Het mechanisme hierachter is nog niet helemaal duidelijk. Waarschijnlijk dragen de hierboven beschreven processen bij aan een abnormale immuunrespons, waardoor patiënten potentieel minder snel zijn met het klaren van een infectie. Daarnaast zijn astmatische longen mogelijk een geschikte omgeving voor ziekteverwekkers om in te overleven. Dit maak astmapatiënten kwetsbaar voor symptomatische luchtweginfecties en/of virusgeïnduceerde cel cytotoxiciteit.9
Uit onderzoek onder kinderen met astma is gebleken dat er vaak een piek van longaanvallen optreedt in het najaar (september). Bij volwassenen is zo’n duidelijke piek er niet. Uit een observationele studie onder 200 patiënten met astma of COPD (zonder longaanval) die met luchtwegklachten bij de huisarts kwamen, werd duidelijk dat met name rhinovirussen en coronavirussen een rol spelen. Een andere observationele studie onder volwassenen die met een influenza infectie waren opgenomen in het ziekenhuis (n=133) liet zien dat astmatische patiënten (n=40, waarvan 70% vrouw) een relatief groot deel vormden. Astmapatiënten met influenza hoefden over het algemeen minder lang in het ziekenhuis te blijven en werden minder vaak geïntubeerd in vergelijking met voorheen gezonde personen. Dit komt waarschijnlijk doordat astmapatiënten vaker een griepvaccinatie hebben gehad (patiënten die een onderhoudsbehandeling met inhalatiecorticosteroïden, langwerkende bronchodilatoren of montelukast nodig hebben, krijgen een griepvaccinatie aangeboden) en door het gebruik van inhalatiecorticosteroïden voorafgaand aan of tijdens de ziekenhuisopname.9
Uit een prospectieve cohortstudie onder zwangere vrouwen met astma (n=168) en zwangere vrouwen zonder astma (n=117) is gebleken dat zwangere vrouwen met astma een grotere kans hebben om tijdens de zwangerschap verkouden te worden. Verkoudsheidsklachten traden met name op in de vroege zwangerschap en postpartum. Onder zwangere vrouwen bij wie een virale infectie middels laboratoriumonderzoek kon worden bevestigd, was 60% van de infecties geassocieerd met ongecontroleerde astma en een verhoogde kans op pre-eclampsie.9
De diagnose astma wordt gesteld op basis van een anamnese in combinatie met lichamelijk onderzoek en longfunctie onderzoek.
In de anamnese is het van belang om te vragen naar (wisselende) dyspneu, een piepende ademhaling, aanhoudende hoestklachten (>3 weken), drukkend gevoel op de borst en/of slijm. Vervolgens is het van belang om naar allergische en niet-allergische uitlokkende prikkels en allergieën te vragen. Daarbij hoort ook de medische voorgeschiedenis, waaronder luchtwegklachten en infecties tijdens de kinderjaren. Bekende comorbiditeiten van allergisch astma zijn andere atopische aandoeningen, zoals constitutioneel eczeem of allergische rinitis, neuspoliepen, bij zichzelf of bij eerstegraads familieleden.2
De rookanamnese is belangrijk aangezien roken de bestaande klachten in stand houdt en om mogelijk te differentiëren tussen astma en COPD.
De volgende aspecten zijn van belang bij lichamelijk onderzoek:
Spirometrie met reversibiliteit of variabiliteit over de tijd is hét aanvullende onderzoek van eerste keus bij de verdenking op astma. Astma is gekenmerkt als een obstructieve longziekte met significante reversibiliteit.
Er kan sprake zijn van astma bij spirometrisch aangetoonde:
De z-score van <-1,64 wordt gebruikt om een normale FEV1 of FEV1/FVC-ratio van afwijkend te onderscheiden.13
Reversibiliteit of variabiliteit wijzen in de richting van astma, maar sluiten COPD niet uit. De afwezigheid van persisterende luchtwegobstructie sluit echter wel COPD uit. Bij een persisterende luchtwegobstructie kan dit wijzen op COPD danwel een ongecontroleerd of langdurig onderbehandeld astma. Daarbij kan ook gedacht worden aan bronchiëctasieën als oorzaak van de persisterende obstructie.
Veel huisartspraktijken hebben de mogelijkheid om zelf spirometrie te verrichten. Daarvoor is wel een CASPIR-cursus of gelijkwaardig vereist. Er dient bovendien voldoende aandacht te worden besteed aan kalibratie van de apparatuur, zodat de FEV1 en de FVC (hoeveelheid uitgeademde lucht bij maximale inademing) niet worden overschat. Spirometrie kan ook worden uitgevoerd in een diagnostisch centrum of longfunctielaboratorium.14
Bij blijvende twijfel over de diagnose astma (bijvoorbeeld bij kenmerkende anamnese met normale spirometrie) is een metacholine- of histamineprovocatietest geïndiceerd. Hierbij worden de luchtwegen geprikkeld met een nevel met een steeds hogere dosis zoutoplossing. Na elke verneveling wordt de FEV1 gemeten. Bij een daling van 20% van de FEV1 ten opzichte van de eerste meting zijn de luchtwegen hyperreactief. De mate van hyperreactiviteit is afhankelijk van de benodigde dosis opgelost zout in de vernevelingen en kan variëren tussen mild, matig en ernstig. Bij een normaal testresultaat is de diagnose astma zeer onwaarschijnlijk (sensitiviteit 100%, specificiteit 93%).15 Een negatieve histamine provocatietest sluit een vorm van astma in de toekomst niet uit.
Een positieve provocatietest toont een astma niet persé aan. Alleen in combinatie met een passende anamnese kan de diagnose worden gesteld, immers kan er ook sprake zijn van tijdelijke para-infectieuze bronchiale hyperreactiviteit zijn.
De Fraction of exhaled Nitric Oxid (FeNO) is een relatief eenvoudige meting die aangeeft of er sprake is van type 2 inflammatie in de luchtwegen. Ondanks dat er invloeden zijn die deze meting kunnen beïnvloeden (zoals roken, koffie, een luchtweginfectie, atopie of behandeling met ICS of anti-IL-4/anti-IL-13 therapie) lijkt het toch als een diagnosticum voor astma te kunnen worden gebruikt. Vanwege de lage sensitiviteit (20%) en nog niet aangetoonde kosteneffectiviteit wordt FeNO op dit moment nog nauwelijks toegepast in de eerste lijn.16,17
De European Respiratory Society heeft FeNO in 2022 opgenomen in haar aanbevelingen voor diagnostiek in de eerste lijn bij volwassen patiënten waarbij astma niet kon worden vastgesteld op basis van spirometrie en een histamine/metacholine provocatietest. De afkapwaarde voor FeNO is vastgesteld op 40 ppb, waarbij een waarde >50 ppb een hoge specificiteit heeft (>90%) en de diagnose astma kan ondersteunen.17
Bloedonderzoek in het kader van astma evaluatie wordt nauwelijks toegepast binnen de eerste lijn. Voor het stellen van de diagnose astma heeft dit ook geen toegevoegde waarde, gezien de lage sensitiviteit (21-59%).17 Bloedonderzoek kan wel worden ingezet bij het bepalen van het fenotype van astma. Hierbij zijn de eosinofielen een biomarker voor type 2 inflammatie. Daarnaast kan in het bloed een screening worden gedaan naar sensibilisatie van bepaalde allergische prikkels. Uiteraard spreken we pas van allergie als er een passende anamnese is, met bijpassend aanvullend onderzoek.
Het belangrijkste doel bij de behandeling van astma is het bereiken van goede astmacontrole. Goede astmacontrole omvat:
Indien goede astmacontrole lastig te realiseren is, kunt u laagdrempelig overleggen met uw regionale kaderhuisarts astma/COPD over de vervolgstappen die u in de eerste lijn kunt zetten om tot goede astmacontrole te komen. Mocht dat niet lukken, is verwijzing naar de tweede lijn (longarts) het advies.
Astma is over het algemeen goed behandelbaar. Klachten kunnen worden uitgelokt door allergische of niet-allergische prikkels. Deze zijn in sommige gevallen te vermijden. Bij een bekende allergie voor huisdieren of huisstofmijt bijvoorbeeld. Ook stoppen met roken of voorkomen dat een astmapatiënt meerookt, kan de klachten verminderen.
Astmapatiënten hebben, net als iedereen, dagelijks tenminste een half uur matig intensieve beweging nodig. Ook als bij lichaamsbeweging de astmaklachten toenemen. Het is mogelijk om patiënten met inspanning gebonden klachten te verwijzen naar een gespecialiseerde oefen- of fysiotherapeut, bij voorkeur met expertise op het gebied van astma.
Medicamenteuze behandeling van astma verloopt in vijf stappen, zie tabel 1. Alle vijf de stappen worden hieronder kort beschreven en zijn schematisch samengevat in figuur 4.
Tabel 1 Stappenplan bij de behandeling van astma in de eerste lijn.
| Stap 1 (optioneel) | Stap 2 | Stap 3 | Stap 4 | Stap 5 | |
| (Onderhouds)behandeling | - | Lage dosis ICS OF lage dosis ICS-formoterol, zo nodig* | LABA + lage dosis ICS OF intermediaire dosis ICS | LABA + intermediaire tot (tijdelijk) hogere dosis ICS OF hogere dosis ICS | Overweeg verwijzing longarts |
| Bij klachten# | Alleen SABA, zo nodig* OF lage dosis ICS-formoterol, zo nodig* OF meteen stap 2 | Bij gebruik ICS-formoterol: extra inhalatie lage dosis ICS-formoterol, zo nodig* (maximaal 8 inh./dag) of aanvullend SABA | |||
| Anders: SABA* | |||||
| # Alleen formoterol-budesonide en formoterol-beclometason zijn voor ‘zo nodig’-gebruik naast onderhoudsbehandeling geregistreerd | |||||
| * Gebruik >2 keer per week wijst op onvoldoende astmacontrole |
Bron: NHG-standaard Astma bij volwassenen2.
Behandeling volgens stap 1 volstaat alleen bij patiënten die incidenteel klachten ervaren, bijvoorbeeld in reactie op een specifiek allergeen. De NHG-standaard adviseert te behandelen met SABA of een lage dosis ICS-formoterol. SABA mag niet vaker dan twee keer per week worden gebruikt. Ga bij een controle-afspraak altijd na of er sprake is van overmatig SABA gebruik (zie ook Monitoring).
Stap 2 bestaat uit een onderhoudsbehandeling met een lage dosis ICS of een lage dosis ICS-formoterol, zo nodig. Continueer ICS gedurende drie maanden en bouw vervolgens af naar een lagere dosis, indien mogelijk. Het volledig staken van ICS is geen doel, tenzij er alleen sprake is van seizoensgebonden klachten. Ga bij een controle-afspraak middels TRIP (Therapietrouw, Rhinitis, Inhalatietechniek, Prikkels) na of er voldoende astmacontrole is (zie ook Monitoring) en of er sprake is van overmatig ICS-formoterol gebruik.
In stap 3 wordt aan de onderhoudsbehandeling met lage dosis ICS een LABA toegevoegd. Bij bijwerkingen van de LABA (palpaties of tremor van de handen) kan ook een LAMA (tiotropium) worden overwogen. Een alternatief is het geven van een intermediaire dosis ICS zonder LABA. Combineer een LABA bij astmabehandeling altijd met een ICS. Gebruik van een LABA zonder ICS geeft een verhoogd risico op ernstige astma-longaanvallen en ziekenhuisopname; in combinatie met een ICS is dit risico niet verhoogd.
Ga bij iedere controle-afspraak middels TRIP na of er voldoende astmacontrole is (zie ook Monitoring). Bij onvoldoende astmacontrole is het mogelijk om een leukotriëenreceptorantagonist (montelukast) aan de behandeling toe te voegen. Geef montelukast niet als alternatief voor ICS, maar als toevoeging. Evalueer na twee maanden of er verbetering is opgetreden en staak montelukast indien de astmacontrole niet verbeterd is of er bijwerkingen zijn. Bijwerkingen van montelukast zijn bovensteluchtweginfecties, hoofdpijn, buikpijn, koorts, huiduitslag, misselijkheid, braken, diarree en een verhoogd ALAT/ASAT.
Behandeling in stap 4 bestaat uit een onderhoudsbehandeling met een intermediaire dosis ICS plus LABA. Een alternatief is het geven van een hogere dosis ICS. Ook in deze stap is de behandeling aangevuld met een lage dosis ICS-formoterol zo nodig, tot maximaal 8 keer per dag. Ga bij een controle-afspraak middels TRIP na of er voldoende astmacontrole is (zie ook Monitoring) en of er sprake is van overmatig ICS-formoterol gebruik (meer dan twee keer per week). Overweeg bij onvoldoende astmacontrole om tiotropium of montelukast aan de behandeling toe te voegen of te verwijzen naar de longarts.
Stap 5 omvat verwijzing naar de longarts. Dit dient te worden overwogen indien met behandeling volgens stap 1 tot en met 4 niet voldoende astmacontrole wordt bereikt binnen drie tot zes maanden. De longarts kan gebruik maken van de volgende behandelmogelijkheden:
Bij elke behandeling met inhalatiemedicatie is het van belang dat de inhalatietechniek wordt gecontroleerd. Bij ruim de helft van alle mensen die inhalatiemedicatie gebruiken gaat dit niet altijd goed. Dit kan resulteren in onderbehandeling of in toename van de bijwerkingen. Daarnaast is therapieontrouw een veel voorkomend probleem in de behandeling van astma.
Er zijn verschillende vormen en dagelijkse frequenties van inhalatiemedicatie. Voor meer informatie hierover kunt u terecht op Inhalatorgebruik.nl. In overleg met patiënt kan worden besloten om de soort inhalator te veranderen om zo therapietrouw en inhalatietechniek te optimaliseren en bijwerkingen te minimaliseren. Probeer bij gebruik van meerdere inhalatoren uniformiteit hierin aan te houden.

Figuur 4 Overzicht van de behandelstappen bij volwassen patiënten met astma.
Bron: Farmacotherapeutisch Kompas18
In uw herhaalmedicatielijst ziet u een aanvraag voor twee puffers salbutamol. U ziet dat Nienke deze aanvraagt.
Nienke is rond haar zevende jaar bij de kinderarts terechtgekomen in verband met recidiverend hoesten en piepen. Daar is destijds de diagnose allergisch astma gesteld door middel van spirometrie en aanvullende allergie-screening. Met beclometason en, zo nodig, salbutamol was ze jarenlang stabiel. Op haar zestiende is ze bij de kinderarts ontslagen met alleen nog medicatie, zo nodig. Ze heeft sinds die tijd geen medicatie herhaald.
Nienke is nu negentien en studeert elders in het land. U hebt met haar afgesproken dat ze wel ingeschreven blijft bij uw praktijk.
Wat doet u met de herhaalaanvraag van Nienke?
U gaat niet zomaar over tot het uitschrijven van de medicatie. U wilt er graag achter komen waardoor de astmaklachten nu weer optreden en de behandeling daarop afstemmen. U neemt daarom contact op met Nienke.
U besluit Nienke te bellen en haar klachten na te vragen. Ze zegt dat ze al een paar weken last heeft van benauwdheid, met name bij het volleyballen. Ze moet dan stoppen met sporten en daar baalt ze van. Vandaar dat ze de puffer besteld heeft. Vroeger werkte die medicatie altijd heel goed bij het sporten. Ze geeft verder aan niet ziek te zijn.
Wat doet u nu?
U geeft Nienke uitleg over de oorzaken van astma en verklaart dat het aanpakken van de oorzaak waarschijnlijk een betere behandelstrategie zal zijn dan symptoombestrijding. U schijft daarom geen salbutamol voor, maar ICS-formoterol. Vanwege de klachten adviseert u deze de komende weken dagelijks te gebruiken.
Astmacontrole wordt op verschillende manieren gemeten. Als eerste is het belangrijk de mate van symptomen te benoemen. Hierbij zijn gevalideerde vragenlijsten een belangrijk hulpmiddel, voornamelijk om de voortgang te monitoren.
Astmacontrole wordt ieder vervolgconsult bepaald aan de hand van de ACQ6 vragenlijst.19
De ACQ vragenlijst bevat zes vragen. Elke vraag heeft zes antwoordopties, waarbij 0 punten betekent dat er geen klachten zijn en 6 punten dat er sprake is van ernstige klachten. De eindscore van de vragenlijst wordt berekend door het totaal aantal behaalde punten te delen door zes. Bij een score ≤0,75 is de astma goed onder controle. Bij een score >0,75 is de astma onvoldoende onder controle.
Ten tweede wordt mate van astmacontrole gemonitord door het uitvragen van het medicatiegebruik, waarbij zowel de onderhoudsdosering van de inhalatiemedicatie van belang is, als het gebruik van escape medicatie. Ook moet worden geïnformeerd naar (milde en ernstige) longaanvallen door middel van stootkuren prednison en eventuele antibioticakuren.
Auscultatie van de longen kan helpen een inschatting te maken van de luchtwegobstructie op dat moment.
Bij onvoldoende astmacontrole is het belangrijk om eerst na te gaan wat de klachten veroorzaakt. Pas als blijkt dat dit door astma komt, kan de medicatie worden aangepast volgens het stappenplan in de NHG-standaard. Zolang de astmacontrole onvoldoende blijft, is monitoring om de zes tot twaalf weken geïndiceerd. Bij een goede astmacontrole is jaarlijkse monitoring voldoende. Bij rokende patiënten, patiënten die stap 3-medicatie gebruiken en patiënten die korter dan drie jaar stap 1- of 2-medicatie gebruiken, wordt naast de vragenlijst jaarlijks spirometrie onderzoek geadviseerd.
Bij patiënten met astma kunnen er meer oorzaken zijn die ervoor zorgen dat klachten blijven bestaan. Daarvoor zijn een aantal jaar geleden de zogenaamde behandelbare kenmerken (‘treatable traits’) gedefinieerd. Dit zijn relevante karakteristieken die de ziektelast bepalen, meetbaar en behandelbaar zijn. Behandelbare kenmerken zijn verdeeld in drie groepen:20
Als de klachten van astma aanhouden wegens risicofactoren of omgevingsfactoren is het zaak om die factoren, waar mogelijk, aan te pakken. Ondersteun uw patiënt bij stoppen met roken, beoordeel regelmatig de therapietrouw en inhalatietechniek en bekijk of de behandeling verder geoptimaliseerd kan worden. Educatie richting de patiënt, en eventueel belangrijke personen uit de sociale omgeving, is hierbij essentieel.20
Als extra-pulmonale kenmerken de oorzaak zijn van aanhoudende astmaklachten is vaak extra diagnostiek en behandeling nodig volgens de geldende richtlijnen van de betreffende aandoening. In ernstige gevallen kunt u daarbij de hulp inroepen van een specialist. Denk bijvoorbeeld aan een diëtist, cardioloog of psycholoog/psychiater.20
Belangrijke pulmonale kenmerken die kunnen zorgen voor aanhoudende astmaklachten zijn eosinofiele luchtweginflammatie en luchtweginfecties. Zoals in het hoofdstuk ‘Diagnostiek’ al werd beschreven, kunnen FeNO en bloedonderzoek onder andere worden ingezet om type 2 inflammatie/eosinofiel astma vast te stellen. Dit is met name van belang voor het inzetten van biologicals in de tweede lijn. Er zijn een aantal biologicals die specifiek werken tegen eosinofiel astma.20
Luchtweginfecties kunnen veroorzaakt worden door virussen of bacteriën. Virale infecties met rhinovirus, influenza en coronavirus komen met name in de herfst en winter veel voor en veroorzaken dan epidemieën. Astmapatiënten die een onderhoudsbehandeling met inhalatiecorticosteroïden, langwerkende bronchodilatoren of montelukast nodig hebben, kunnen zich preventief laten vaccineren tegen bijvoorbeeld influenza en corona om de kans om een ernstig verloop van de infectie te verminderen. Patiënten die toch een ernstige virale infectie ontwikkelen, kunnen behandeld worden met antivirale middelen. Bacteriën die luchtweginfecties kunnen veroorzaken zijn bijvoorbeeld Chlamydia pneunomiae, Mycoplasma pneunomiae, Streptococcus pneumoniae en Haemophilus influenzae. Bij behandeling van deze infecties is antibiotica geïndiceerd.9
Astma kan tijdelijk worden verergerd, waarbij een patiënt veel meer klachten heeft. Dit noemen we een longaanval. Een longaanval kan door verschillende prikkels worden uitgelokt, zoals allergische prikkels, niet-allergische prikkels of virale/bacteriële infecties. Als patiënten vaker longaanvallen hebben, kan elke longaanval door een andere prikkel zijn uitgelokt.
In eerste instantie is het belangrijk om er proberen achter te komen waardoor de longaanval is uitgelokt. Daarnaast is lichamelijk onderzoek van belang om de ernst van een longaanval te bepalen. Voornamelijk de ademfrequentie, het gebruik van hulpademhalingsspieren, de perifere saturatie en auscultatie zijn van belang. Bij auscultatie van iemand met een longaanval kan over het algemeen een piepend en/of brommend verlengd expirium worden gehoord. Bij een verminderd ademgeruis bij iemand met een astmatische longaanval moet men denken aan ‘silent chest’, waarbij patiënt direct mag worden verwezen.
Er is sprake van een ernstige longaanval bij ≥1 van de volgende criteria:
Als al deze criteria afwezig zijn of bij een vlotte verbetering na salbutamol inhalatie, is er sprake van een minder-ernstige longaanval.
De behandeling van een minder-ernstige longaanval bestaat uit het verhogen van de inhalatiemedicatie volgens het stappenschema. Daarnaast moet de uitlokkende factor zo mogelijk worden behandeld.
Bij verdenking op een bacteriële infectie, eventueel gesterkt door een verhoogd C-reactief proteïne (CRP) als oorzaak van de longaanval, kan worden overwogen om antibiotica in te zetten.
Orale corticosteroïden, voornamelijk prednisolon, hebben een belangrijke rol in de behandeling van ongecontroleerd astma. Bij een ernstige longaanval is, naast het ophogen van de inhalatiemedicatie, een stootkuur met prednisolon geïndiceerd. Hierbij wordt 5 dagen 40mg prednisolon gegeven.
Er is geen rol voor onderhoudsbehandeling met prednisolon in de huisartsenpraktijk. Als een patiënt twee of meer longaanvallen per jaar heeft of het lukt niet om de prednisolon af te bouwen, verwijs dan naar een longarts.
Langdurig gebruik van prednisolon brengt verschillende risico’s met zich mee, waaronder diabetes, obesitas, osteoporose en op den duur bijnierschorsinsufficiëntie. Het is van groot belang deze complicaties te voorkomen aangezien ze een negatief effect kunnen hebben op de controle van astma.
Nienke is, in overleg, gestart met de behandeling met ICS-formeterol. Een week later komt ze langs op uw spreekuur. De behandeling heeft niet geholpen bij het sporten en na een paar dagen is Nienke ziek geworden met klachten van keelpijn, hoesten en heesheid. Ze heeft in de bijsluiter van het geneesmiddel gelezen dat heesheid een bijwerking kan zijn en is daarom gestopt met de medicatie.
Nienke oogt duidelijk ziek en dyspnoeisch. Uit de anamnese en het lichamelijk onderzoek komt het volgende naar voren:
Wat is uw diagnose?
U stelt vast dat er bij Nienke sprake is van een longaanval. Dit kan zijn veroorzaakt door een luchtweginfectie, waarbij een eventuele CRP kan helpen differentiëren tussen een virale of een bacteriële luchtweginfectie.
Omdat er mogelijk sprake is van een bacteriële infectie laat u het CRP bepalen. Het gemeten CRP is 19. U besluit om geen antibiotica in te zetten.
Moet u de astmabehandeling van Nienke aanpassen en zo ja, hoe?
Ja. U past de dosering van de medicatie van Nienke aan tot tijdelijk hoog. U maakt een afspraak te bellen bij verslechtering, zodat eventueel prednisolon toegevoegd kan worden. Daarnaast maakt u alvast een controleafspraak en een afspraak bij de POH om het longaanval actieplan te bespreken.
Twee weken later meldt de POH dat het wat beter gaat met Nienke en dat een stappenplan om medicatie op te hogen bij klachten met haar is doorgenomen. Nog eens twee weken later komt ze terug op het spreekuur om haar hoge dosering met u te bespreken.
Overdag heeft ze geen klachten en ze gebruikt ook geen extra ICS/formoterol meer, al houdt ze de volleybaltraining nog niet helemaal vol. Dat wijt ze aan de verminderde conditie, niet aan haar luchtwegen. Ze is dus zeker opgeknapt, maar blijft nog steeds verkouden en loopt met name ’s nachts vol. Ook moet ze dan meer hoesten. Ze vraagt zich af of ze haar medicatie op mag hogen en informeert bij u naar mogelijke andere behandelopties.
Wat kunt u Nienke adviseren?
Omdat ze al op een hoge dosering zit, is ophogen van de medicatie nu geen optie. In verband met uitsluitend nachtelijke klachten en bij longonderzoek geen piepend/verlengd expirium, denkt u aan een allergische component. U stelt voor een neusspray en antihistaminicum te gebruiken en te zien wat dat doet op haar klachten, naast het terugzetten van haar astmamedicatie naar stap 3.
Met een corticosteroïden neusspray en antihistaminicum gaat het jarenlang goed. Nienke gebruikt de ICS/formoterol zo nodig en maakt bij toename van klachten gebruik van het stappenplan zoals opgenomen in het longaanval actieplan.
Als Nienke 23 is, is ze klaar met de PABO en staat ze fulltime voor de klas. Er valt haar een toename van heesheid op en dus neemt ze weer contact met u op. Deze keer is er geen sprake van benauwdheid bij het volleyballen.
Wat kan hier aan de hand zijn?
Vanwege haar beroep kunt u denken aan terugkerende luchtweginfecties die astmaklachten verergeren. Gezien er geen sprake is van benauwdheid bij het sporten, ligt een bijwerking van de huidige medicatie meer voor de hand.
Nadat u haar therapietrouw (gebruik inhalatiemedicatie zo nodig, neusspray en antihistaminicum dagelijks) en inhalatietechniek heeft gecontroleerd (waarbij Nienke aangeeft voor het tandenpoetsen te inhaleren en te spoelen), schrijft u ciclesonide voor met salbutamol, zo nodig. De POH ziet Nienke na twee weken terug voor een evaluatie. Ze is tevreden met hoe het gaat en blijft op deze medicatie. Ze weet dat ze zich opnieuw moet melden als ze vaker dan twee keer per week salbutamol nodig heeft.
Wanneer zou Nienke zich nog meer mogen melden, gezien haar leeftijd en ciclesonide gebruik?
Nienke zou zich ook mogen melden als ze zwanger is of zwanger zou willen worden. De risico’s van het gebruik van ciclesonide tijdens de zwangerschap zijn onbekend. Ciclesonide dient daarom alleen op strikte indicatie gebruikt te worden. Bij zwangerschap zijn beclometason, budesonide en fluticason het meest veilig om te gebruiken.21
Astma is de meest voorkomende chronische longaandoening tijdens de zwangerschap. Jaarlijks zijn er in Nederland naar schatting ongeveer 10.000 zwangere vrouwen met astma. Een derde van de zwangerschappen gaat gepaard met verslechtering van de astmacontrole. Onvoldoende astmacontrole is geassocieerd met ongunstige zwangerschapsuitkomsten, zoals vroeggeboorte en een laag geboortegewicht. Bij vrouwelijke astmapatiënten in de vruchtbare leeftijd is het essentieel om het onderwerp ‘kinderwens’ bespreekbaar te maken en het belang van goede astmacontrole en het voorkomen van longaanvallen voor en tijdens de zwangerschap te benadrukken.21
De meeste inhalatiemedicatie mag tijdens de zwangerschap gewoon gebruikt worden en een step-down van de onderhoudsmedicatie is in principe niet nodig. Wel is het verstandig om middelen te gebruiken waarmee de meeste ervaring is opgedaan bij zwangeren. Voor ICS zijn dit budesonide, beclometason en fluticason. Bij LABA gaat het om formoterol of salmeterol.21
Op de website Geneesmiddelgebruik rondom de zwangerschap van Lareb vindt u meer informatie over de veiligheid van geneesmiddelen en vaccinaties bij kinderwens, zwangerschap en borstvoeding.
Nog een aantal jaren later is Nienke getrouwd en terugverhuisd naar haar geboortedorp. Ze is inmiddels 25 weken zwanger en gebruikt nu alleen beclometason onderhoud. Ze merkt dat ze de laatste weken zeker twee keer per week salbutamol nodig heeft en maakt zich hier zorgen over.
Wat kunt u in deze situatie doen?
Goede astmacontrole is tijdens de zwangerschap essentieel om complicaties te voorkomen. U kunt de medicatie daarom omzetten naar ICS-formoterol.
In de 31e week van de zwangerschap meldt Nienke zich met koorts (38,6◦C) en benauwdheid. Ze maakt zich veel zorgen om haar baby, die ze wel goed voelt bewegen. Tijdens anamnese en lichamelijk onderzoek stelt u het volgende vast:
Wat doet u?
Gezien de saturatie <94% in combinatie met de extra ademarbeid, dient u eerst 4x100 ug salbutamol via voorzetkamer toe. Hierop stijgt de saturatie naar 96% en ademt Nienke zonder hulpademhalingsspieren, nog iets verhoogde frequentie van 22/min.
Gezien de zwangerschap van Nienke en het risico op complicaties is in dit geval een stootkuur prednisolon geïndiceerd. Daarnaast geeft u instructies over extra inhalatie de eerste 24 uur en doet u daarna een nacontrole.
Bij een ernstige longaanval weegt het voorkomen van hypoxemie zwaarder dan de eventuele risico’s van systemische corticosteroïden voor de foetus en de zwangere (zwangerschapshypertensie, vroeggeboorte, groeivertraging en laag geboortegewicht). Behandel een longaanval tijdens de zwangerschap op dezelfde manier als buiten de zwangerschap.
Een klein deel (3-4%) van alle volwassenen met astma heeft ernstig astma.22 Ernstig astma is gedefinieerd als ongecontroleerd astma met een hoge klachtenlast, frequent longaanvallen of de noodzaak tot onderhoudsbehandeling met orale corticosteroïden, ondanks een maximale behandeling met hoge dosis inhalatiecorticosteroïden en optimale behandeling van de behandelbare kenmerken. Deze patiënten moeten worden verwezen naar een gespecialiseerde longarts.
Het doel van de behandeling van patiënten met ernstig astma is het voorkomen van veelvuldig gebruik van orale corticosteroïden. De afgelopen decennia is er een enorme ontwikkeling geweest in de behandeling van patiënten met ernstig astma. Verschillende biologicals zijn ontwikkeld die zich specifiek richten op onderliggende mechanisme in astma (tabel 2). Hierbij is het voor de longarts van belang een goed beeld te krijgen van welke mechanismen een rol spelen in de patiënt. De huisarts kan hierin een rol spelen door het verloop van de ziekte en behandeling vanaf het begin goed in kaart te brengen.
Een behandeling van een biological wordt geëvalueerd na vier tot zes maanden.
Tabel 2 Behandelmogelijkheden bij ernstig astma.
| Naam | Aangrijpingsmechanisme | Indicatie* | Toelichting biomarkers | Toediening |
| Omalizumab | IgE | Ernstig allergisch astma | Verhoogde IgE en/of allergie (RAST) | Subcutaan elke 2-4 weken |
| Mepolizumab | IL-5 | Ernstig eosinofiel astma | Verhoogde eos | Subcutaan elke 4 weken |
| Reslizumab | IL-5 | Ernstig eosinofiel astma | Verhoogde eos | Intraveneus elke 4 weken |
| Benralizumab | IL-5 receptor | Ernstig eosinofiel astma | Verhoogde eos | Subcutaan elke 8 weken |
| Dupilumab | IL-4 receptor (IL-4 en IL-13) | Ernstig astma met type 2 inflammatie | Verhoogde FeNo en/of eos | Subcutaan elke 2 weken |
| Tezepelumab | TSLP | Ernstig astma | n.v.t. | Subcutaan elke 4 weken |
| * Raadpleeg de SmPC voor de volledige indicatietekst. Biologicals zijn een aanvullende onderhoudsbehandeling bij patiënten die onvoldoende onder controle zijn, ondanks hoog gedoseerde inhalatiecorticosteroïden met een ander geneesmiddel als onderhoudsbehandeling. |
Bronnen: SmPC’s Xolair, Nucala, Cinqaero, Fasenra, Dupixent, Tezspire23-28.
Astma is een complexe ziekte waar verschillende mechanismen aan ten grondslag liggen. Astma is goed te behandelen, maar monitoring van de astmacontrole is daarbij wel essentieel. Behandelbare kenmerken zoals roken, onderliggende aandoeningen of terugkerende luchtweginfecties kunnen astmaklachten in stand houden of een longaanval uitlokken. Het is belangrijk om deze kenmerken te herkennen en te behandelen. Bij aanhoudende onvoldoende astmacontrole, ondanks goed ingestelde behandeling, is er in het stappenplan van de NHG-standaard genoeg ruimte om de therapie aan te passen, laagdrempelig te overleggen met een kaderarts astma/COPD of de patiënt te verwijzen naar de longarts.