Inleiding
Dit FTO-Online artikel geeft inzicht in de diagnostiek en behandeling van een grote verscheidenheid aan seksueel overdraagbare aandoeningen (soa’s). Hierbij worden soa-gerelateerde klachten zoals urethritis en fluor- en vaginitisklachten buiten beschouwing gelaten. De rol van de huisarts komt uitgebreid aan bod: preventie, het testen op soa’s, partnerwaarschuwing, soa-counseling, diagnostiek en behandeling.
De volgende specifieke soa’s komen aan de orde: anogenitale wratten, chlamydia, gonorroe, herpes genitalis, scabiës, syfilis en trichomoniasis. Hierbij zijn aanbevelingen uit de Multidisciplinaire richtlijn seksueel overdraagbare aandoeningen uit 2018 als uitgangspunt genomen.1
Lijst van afkortingen
Preventie
Soa’s behoren tot de infectieziekten. In de Engelstalige literatuur wordt de correctere term sexually transmitted infections gebruikt. Genezing van een soa zonder interventie komt voor, maar in het algemeen vraagt een soa – met of zonder klachten – om behandeling. Voorkómen van verspreiding en gezondheid van het individu zijn hierbij het uitgangspunt.
De zorg voor soa kan niet los worden gezien van de totale aanpak van vraagstukken op het gebied van seksuele gezondheid. Het Nederlandse beleid ten opzichte van soa’s en hiv richt zich vooral op het voorkomen dat de aandoeningen zich binnen de bevolking verspreiden. Er gaat met name aandacht uit naar de opsporing en preventie in specifieke risicogroepen om transmissie te voorkomen en er wordt adequate behandeling geboden. Soa-zorg wordt zowel landelijk als lokaal door de huisarts, medisch specialisten (bijvoorbeeld dermatologen) en de Centra Seksuele Gezondheid (CSG) bij de GGD uitgevoerd.
Soa-preventie kan een aanzienlijke gezondheidswinst betekenen. Omdat het verloop van de meeste soa’s asymptomatisch kan zijn, hebben mensen niet door dat ze geïnfecteerd zijn en kunnen ze de infectie ongemerkt overdragen. Preventie is gericht op het voorkomen van (overdracht van) soa’s, het voorkómen van complicaties en het bevorderen van veilig vrijen door middel van voorlichting en begeleiding. Twee belangrijke pijlers in de preventiezorg zijn het behandelen van soa’s en het zo vroeg mogelijk opsporen van soa’s door actief te testen. Bij een vastgestelde infectie wordt (meestal) partnerwaarschuwing en -behandeling aanbevolen om herinfectie en verdere verspreiding te voorkomen en symptoomloze partners op te sporen.
Soa-zorg in Nederland
De huisartsen in Nederland spelen een belangrijke rol in het diagnosticeren en behandelen van soa’s. Zo wordt naar schatting 70% van de soa-consulten door de huisartsen gedaan en is 80-85% van alle soa-diagnosen afkomstig van de huisarts.2
In Nederland bestaan acht soa-regio's die elk door een GGD wordt gecoördineerd, dit zijn de Centra Seksuele Gezondheid (CSG). Aanvullend op het reguliere aanbod van soa-zorg door huisartsen en specialisten, voeren zij de regeling aanvullende seksuele gezondheid uit. Deze is bedoeld om laagdrempelig kwalitatief goede soa-zorg te bieden.
Doelgroepen
Jongeren en jongvolwassenen die nog maar kort seksueel actief zijn vormen een groep met een hogere kans op het krijgen van een soa. In deze levensfase is er vaker wisselend seksueel contact en kan er sprake zijn van onervarenheid met veilige seks. Dit leidt ertoe dat in deze leeftijdsgroep relatief vaker urogenitale chlamydia-infectie wordt aangetroffen.
Mannen die seks hebben met mannen (MSM) vormen een andere groep waarbij op basis van epidemiologische gegevens vaker een soa wordt gediagnosticeerd. Het begrip MSM vereist een nadere toelichting. Voor een goede inschatting van de kans op een soa is niet zozeer iemands seksuele identiteit (onder meer homoseksueel, heteroseksueel georiënteerd) van belang. Een getrouwde, zich als monogaam heteroseksueel identificerende man kan buiten zijn vaste relatie ook seks hebben met mannen en vrouwen en daarmee een verhoogd risico lopen op een soa. Als hiernaar niet specifiek wordt gevraagd (“Heeft u seks met mannen en/of met vrouwen?”), kan relevante informatie omtrent risicogedrag worden gemist.
Een andere doelgroep bestaat uit de groep hiv-geïnfecteerden, die nog niet op de hoogte zijn van hun status. Om op tijd te kunnen starten met behandelen, complicaties te beperken en verspreiding van hiv te beperken, is kennis van de eigen hiv-status essentieel. Deze patiënten kunnen gevonden worden door actiever te vragen naar gedrag en het afnemen van een soa-test, hier ligt een grote rol voor de huisarts.
Andere doelgroepen zijn swingers, mensen uit hiv-endemische gebieden en sekswerkers/prostituanten. Bij de GGD kan gratis – en indien gewenst anonieme – informatie en aanvullende seksuele gezondheidszorg verkregen worden, zie kader 1.
Kader 1 Doelgroepen voor gratis soa-zorg
Voor soa-zorg gaat het om de volgende personen:
-
Mannen die seks hebben met mannen (MSM)
-
Prostituees (in de laatste 6 maanden)
-
Personen afkomstig uit een soa-endemisch gebied (Suriname, Nederlandse Antillen, Turkije, Marokko, Afrika, Zuid-Amerika, Azië, Oost Europa)
-
Personen met een partner uit de doelgroep MSM, prostituee, prostituant of soa-endemisch gebied
-
Personen die in het kader van de bron- en contactopsporing gewaarschuwd zijn voor een soa
-
Personen met klachten die wijzen op een soa
-
Personen jonger dan 25 jaar
Bron: RIVM3
Soa-surveillance
De surveillance van soa is in Nederland gebaseerd op gegevens van de Centra Seksuele Gezondheid (CSG) en op gegevens van de NIVEL Zorgregistraties eerste lijn. In tegenstelling tot veel andere Europese landen is er in ons land geen meldingsplicht voor soa, met uitzondering van acute en chronische hepatitis B en acute hepatitis C.4 Figuur 1 geeft een overzicht van het aantal soa-consulten bij de CSG en bij de huisarts in de afgelopen jaren.
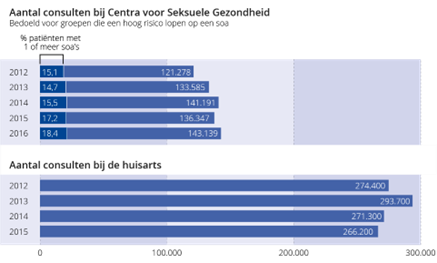
Figuur 1 Aantal soa-gerelateerde consulten bij CSG en de huisartsenpraktijk.
Bron: Van Bergen, 20184
Tabel 1 Vragen passend bij verschillende klachten.
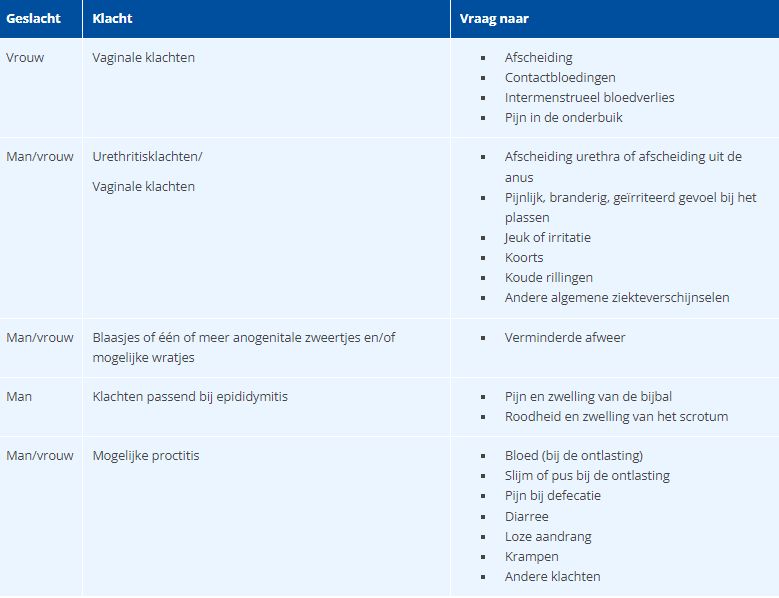
Vraag in een soa-consult altijd naar klachten, seksuele voorkeur en seksueel gedrag; deze bepalen samen het beleid. Verricht bij patiënten met klachten en die behoren tot een risicogroep onderzoek naar Chlamydia trachomatis, gonorroe, syfilis, hiv en hepatitis B. Vul dit, afhankelijk van de klachten, aan met overige specifieke diagnostische tests. Maak bij patiënten zonder klachten, maar behorend tot een risicogroep, een inschatting op grond van afkomst en gedrag (nu of in het verleden) of er onderzoek verricht moet worden naar Chlamydia trachomatis, gonorroe, syfilis, hiv, hepatitis B of C. Of dat eventueel volstaan kan worden met een hiv-test en hepatitis-B-test of een chlamydiatest. Bied in elk geval laagdrempelig een hiv-test en zo nodig een hepatitis-B-test aan bij mensen afkomstig uit respectievelijk hepatitis B endemisch gebied en bij mannen die seks met mannen (MSM) hebben (gehad). Bied jongeren onder de 25 jaar in elk geval laagdrempelig een chlamydiatest aan.
Bij patiënten met klachten en die niet behoren tot een risicogroep vindt gericht diagnostisch onderzoek plaats. Neem op indicatie en afhankelijk van de wijze van seksueel contact ook tests af van andere mogelijke infectieplaatsen dan de genitaliën (zoals het rectum). Voorlichting over veilig vrijen en partnerwaarschuwing zijn belangrijke aspecten van het soa-consult. De behandeling is afhankelijk van de specifieke verwekker, dit wordt verderop in dit artikel besproken. Bij PID (pelvic inflammatory disease), urethritis, epididymitis of proctitis en vermoeden van een soa kan een behandeling worden gestart voordat de verwekker bekend is. Bied ongevaccineerde, hepatitis-B-negatieve MSM, vaccinatie aan.
Contactwaarschuwing (en partnerbehandeling)
Bij bewezen infectie is opsporing van andere (potentieel) geïnfecteerden van belang om verspreiding van infectie en ziekte te voorkomen. Een gezamenlijke aanpak van de huisarts of GGD in samenwerking met de patiënt is daarbij belangrijk. Een hulpmiddel bij het opsporen van partners is www.partnerwaarschuwing.nl waarbij ook anoniem aan partners een soa kan worden gemeld. Inmiddels is de opsporing van partners met een soa door dit hulpmiddel toegenomen.
Een belangrijk knelpunt van partnerwaarschuwing bij MSM zijn de vele en vaak anonieme contacten die niet of moeilijk te achterhalen zijn. Van de MSM met een soa was 46% van alle partners te achterhalen. Van de heteroseksuele vrouwen wist 87% de contacten te achterhalen; bij heteromannen was dit 63%. De partners die de MSM kunnen achterhalen worden vervolgens bijna altijd gewaarschuwd (92%). Dit percentage was lager bij heteroseksuele mannen (76%) en vrouwen (83%). Bij 33 tot 50% van de gewaarschuwde partners, afhankelijk van de risicogroep, werd een soa opgespoord.7
Counseling (advies over veilige seks)
Voorlichting over veilig vrijen verdient aandacht. Het is de derde C (counseling) in het soa-consult. Adviezen bij gediagnosticeerde infecties hebben betrekking op veilig vrijen, maar ook op behandeling en het belang van partnerwaarschuwing.
Belangrijkste aandachtspunten in de NHG-Standaard Het soa-consult6
-
Materiaal voor een test op chlamydia en gonorroe bij de vrouw wordt afgenomen met een vaginale wattenstok (door de vrouw zelf of anders door de huisarts). Afname van materiaal uit cervix/urethra of urineonderzoek bij asymptomatische vrouwen wordt niet meer geadviseerd. Bij de man is onderzoek van de eerste straal urine de eerste keus bij tests op chlamydia en gonorroe
-
Herpes genitalis kan op klinische gronden worden gediagnosticeerd. Bij twijfel over de aard van de laesies kan een PCR (bij actieve laesies) worden afgenomen
-
Zwangere vrouwen met een chlamydia-infectie (evenals niet-zwangere vrouwen en mannen) worden behandeld met eenmalig azitromycine 1 gram oraal
-
Vanwege toenemende resistentie voor antibiotica is de eerste keus bij gonorroe eenmalig ceftriaxon 500 mg i.m.
Vroegtijdige opsporing van hiv en hepatitis wordt actiever aanbevolen omdat effectieve behandeling voorhanden is en tijdige behandeling de levensverwachting verbetert en de transmissie vermindert.
Anogenitale wratten (AGW)
Anogenitale wratten (AGW) of condylomata acuminata zijn een van de meest voorkomende soa‘s en de meest frequent voorkomende virale soa wereldwijd. De wratten zijn goedaardig en worden veroorzaakt door bepaalde typen van het humaan papillomavirus. De humaan papillomavirussen worden ingedeeld in laag risico en hoog risico. Laag risico wil normaal gesproken zeggen niet-oncogeen, zoals het geval is bij AGW. Hoog risico wil zeggen potentieel oncogene infecties.1
Veroorzaker
De humaan papillomavirussen (HPV) zijn kleine DNA-virussen. Ze worden onderscheiden in een cutane groep, die huidafwijkingen (wratten) veroorzaakt, en een mucosale groep, die genitale afwijkingen geeft. Binnen de mucosale HPV’s wordt onderscheid gemaakt tussen de non-oncogene en oncogene HPV-typen. Er zijn momenteel meer dan 100 verschillende HPV-typen bekend, waarvan ten minste 35 het genitale epitheel kunnen infecteren. Tot de genitale groep behoren ook HPV-6 en HPV-11. Deze twee typen veroorzaken >90% van de AGW en worden gezien als low-risk HPV-typen.
Epidemiologie
AGW komen overal in de wereld voor. De laatste 20-30 jaar is er een forse stijging geweest in de prevalentie. De meeste AGW worden gezien in de leeftijd 15-29 jaar. Meer dan 50% van alle seksueel actieve personen zijn ooit geïnfecteerd door een of meer HPV-typen; sommige schattingen spreken zelfs over 80%. De meeste infecties zijn asymptomatisch en zonder consequenties. Van de geïnfecteerden ontwikkelt mogelijk slechts 1% AGW. 8,9,10 In 2017 is de diagnose genitale wratten in Nederland 1.619 keer gesteld bij de Centra Seksuele Gezondheid. Veruit het grootste deel van de genitale wratten werd gesteld bij de huisarts: in 2016 waren er naar schatting 37.500 diagnoses voor genitale wratten. De huisarts rapporteerde vaker genitale wratten bij mannen dan bij vrouwen (58% versus 42%).2 De gemiddelde leeftijd van vrouwen en heteroseksuele mannen was 24-27 jaar; bij MSM was dit gemiddeld 38 jaar. De meest voorkomende co-infectie is, in 10% van de gevallen, chlamydia-infectie, wat uiteraard goed te verklaren is door het feit dat beide soa’s een hoge prevalentie hebben.2
Symptomen
Infecties met HPV zijn meestal asymptomatisch. Afhankelijk van het type geven ze verschillende ziektebeelden. HPV-typen 1, 2 en 4 veroorzaken de gewone huidwratten en zijn overdraagbaar via direct huid op-huidcontact, voornamelijk onder kinderen. Slechts een klein deel van de geïnfecteerde personen ontwikkelt daadwerkelijk genitale wratten, omdat HPV-infecties (ook de oncogene typen) veelal latent zijn.9 Infecties veroorzaakt door HPV-6 of HPV-11 zijn seksueel overdraagbaar en hebben als klinisch beeld condylomata acuminata. De door HPV-6 of HPV-11 veroorzaakte condylomata acuminata zijn scherp begrensde verhevenheden die een verruceus (bloemkoolachtig) oppervlak hebben.
Voorkomende klachten zijn jeuk, pijn of een brandend gevoel, soms vaginale afscheiding of afscheiding uit de urethra. Bij de man zijn de voorkeurslokalisaties van de wratten de penis, scrotum, meatus urethrae en het perianale gebied. Bij de vrouw zijn de voorkeurslokalisaties de introïtus, vulva, clitoris, perineum en het perianale gebied. Soms worden AGW ook gevonden in de vagina en op de cervix.8,11,12 Wratten rond de anus hoeven niet te betekenen dat er anale seksuele contacten zijn geweest; voor intra-anale wratten geldt dat wel.12,13 Condylomata geven cosmetische klachten, maar kunnen ook een psychoseksuele belasting vormen. Daarnaast kunnen condylomata ook obstructies veroorzaken van bijvoorbeeld de urethra of anus.
Diagnostiek
De diagnose geschiedt voornamelijk op basis van het klinische beeld. Het is niet gebruikelijk om een biopt te nemen voor histologisch en HPV-onderzoek. Een standaard soa-onderzoek is wel aan te bevelen (inclusief speculumonderzoek bij vrouwen en proctoscopisch onderzoek bij perianale wratten), waaronder syfilisserologie ter differentiatie met condylomata lata.
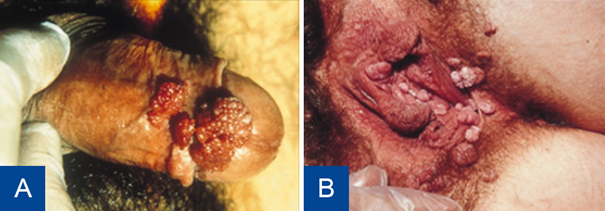
Figuur 2 Genitale wratten.
Bron: Soa Aids Nederland
Behandeling
In het algemeen geneest een HPV-infectie zonder behandeling. Van nieuwe infecties was 20% na 3 maanden spontaan genezen en 90% na 2 jaar.10Wanneer een patiënt met condylomata behandeling wenst, kan hij kiezen voor medicamenteuze behandeling, cryotherapie of elektrocoagulatie. Medicamenteuze behandeling is mogelijk met lokale applicatie (niet toepassen op bloedende wratten, open wonden of moedervlekken). Een behandeling die gestart wordt bij beginnende condylomata is effectiever dan bij langer bestaande laesies. Huisarts en patiënt maken een afweging tussen behandeling door de huisarts of thuisbehandeling door de patiënt. Bij lokale applicatie wordt de omringende (gezonde) huid beschermd met vaseline.
De belangrijkste reden om AGW te behandelen is cosmetisch, meestal heeft de patiënt veel last van schaamte, dit heeft grote invloed op het seksleven en relatie(s). Daarnaast kunnen AGW ook obstructies veroorzaken van bijvoorbeeld de urethra of anus. Er bestaan verschillende vormen van ablatieve (weefselvernietigende) behandeling van condylomata. De hiermee gepaard gaande weefseldestructie brengt vervolgens een lokale immunologische reactie op gang, die uiteindelijk het virus opruimt. Ongeacht de behandelmethode varieert het genezingspercentage tussen 32 en 88%. Bij behandeling door de huisarts zelf stipt deze wekelijks de condylomata aan met trichloorazijnzuur 80 tot 90%. Andere destructieve therapieën kunnen ook worden toegepast, zoals laser-, cryo- en elektrochirurgie, al dan niet in combinatie met lokale therapie door de patiënt.
Tabel 2 Medicamenteuze behandeling van condylomata acuminata door de patiënt zelf.

Nazorg/monitoring
Nazorg is niet nodig indien zichtbare AGW zijn verdwenen. Patiënten kunnen zelf in de gaten houden of nieuwe AGW optreden, dit kan vooral het geval zijn in de eerste 3 maanden na de behandeling. Soms kan het lastig zijn om AGW te constateren (met name bij interne afwijkingen). Om deze reden wordt een nacontrole geadviseerd na 3 maanden. Indien er sprake is van urethrale afwijkingen, verder dan de fossa navicularis, wordt altijd een controle-urethroscopie geadviseerd. Ook als er geen sprake is van klachten en met name bij immuungecompromitteerden. De patiënt kan uit controle ontslagen worden wanneer er geen recidieven aanwezig zijn. Voor sommige patiënten kan een eerdere controle zinvol zijn om behandelingscomplicaties in de gaten te houden en aanvullende voorlichting te geven over het voorkomen van AGW. Vrouwen met AGW kunnen zonder verkorte tussenpozen meedoen aan het landelijk onderzoeksprogramma naar baarmoederhalskanker. Het is niet zinvol om een aanvullende uitstrijk van de cervix af te nemen.11
Primaire preventie van anogenitale wratten en baarmoederhalskanker
De HPV-vaccins bieden bescherming tegen HPV-16 en -18 die verantwoordelijk zijn voor 70% van alle gevallen van baarmoederhalskanker. Met het bivalente vaccin worden meisjes van 9 tot 12 jaar gevaccineerd in het rijksvaccinatieprogramma. Vaccinatie met het bivalente vaccin leidt tot enige vermindering van de kans op AGW. Ook meisjes in de leeftijd van 13 tot en met 26 jaar die nog geen vaccin hebben ontvangen, komen voor vaccinatie in aanmerking. In deze leeftijdsklasse is het effect voor het begin van de seksuele activiteit het grootst. Het quadrivalente vaccin biedt ook bescherming tegen HPV-6 en HPV-11, die 90% van de genitale wratten veroorzaken. Dit vaccin kan tevens aan jongens in de leeftijdscategorie 9-26 jaar toegediend worden, om genitale wratten te voorkomen en transmissie te verkleinen.
Chlamydia
Chlamydia trachomatis (Ct) is een obligaat intracellulaire bacterie die elk jaar wereldwijd meer dan 100 miljoen mensen infecteert tijdens seksuele overdracht. Overdracht van Ct vindt meestal plaats door direct slijmvliescontact tussen twee individuen tijdens de geslachtsgemeenschap (vaginaal, anaal), tijdens orale seks, of bij de geboorte via een geïnfecteerde baarmoederhals. De meerderheid van de mensen met Ct-infecties zijn zich er niet bewust van, want urogenitale infecties verlopen vaak asymptomatisch. Urogenitale Ct-infecties kunnen leiden tot ernstige complicaties bij vrouwen, zoals pelvic inflammatory disease (PID). Deze complicaties kunnen leiden tot onvruchtbaarheid, ectopische zwangerschap en chronische bekkenpijn, en kunnen gevolgen hebben voor de zwangerschap en de pasgeborene. Urogenitale Ct-infecties resulteren niet in een langdurige immuniteit.
Veroorzaker
Ct is een gramnegatieve bacterie die obligaat intracellulair leeft en zich vermenigvuldigt. Ct-organismen zijn niet waarneembaar met een lichtmicroscoop maar wel de door de infectie optredende intracellulaire insluitsels (inclusielichaampjes). Ct-typen worden op grond van de klinische verschijnselen die zij veroorzaken onderscheiden in zogenoemde biovars, te weten trachoom, anogenitale Ct-infectie en lymphogranuloma venereum (LGV).
Epidemiologie
Geschat wordt dat per jaar in Nederland 60.000 personen geïnfecteerd raken met Chlamydia trachomatis. Een groot gedeelte van deze infecties verloopt zonder symptomen bij zowel mannen (50%) als vrouwen (70-80%).14 Chlamydia is de meest voorkomende soa in 2015, getest door zowel huisartsen als de CSG. Met 18.585 diagnosen bij de CSG en naar schatting 34.000 bij huisartsen in 2014. Chlamydia werd het meest vastgesteld bij heteroseksuelen, zowel mannen als vrouwen, onder de 25 jaar.15 Lymfogranuloma venereum (LGV) is een agressieve variant van anale chlamydia die vooral bij hiv-geïnfecteerde MSM voorkomt. Na de uitschieter in 2012 wordt jaarlijks op de CSG bij zo’n 100-200 mensen met anale chlamydia-infectie na doortypering LGV vastgesteld.16
Symptomen
Tot 90% van de urogenitale Ct-infecties verloopt zonder klachten.17 Slechts een klein deel van de vrouwen bij wie Ct uit de cervix en/of urethra is geïsoleerd, heeft klachten zoals pijnlijke of branderige mictie, veranderde afscheiding (waterige fluor), bloedverlies tussen de menstruaties in, pijn of bloedverlies bij seksueel contact en pijn in de onderbuik (verdenking PID).18
Ct-infecties bij de vrouw kunnen opstijgen en complicaties veroorzaken zoals endometritis, salpingitis, perihepatitis (syndroom van Fitz-Hugh-Curtis) en een tubo-ovarieel abces. Een combinatie van deze klachten is bekend onder de verzamelnaam pelvic inflammatory disease (PID) en wordt vaak gekenmerkt door een geprikkelde buik, koorts en algehele malaise. Gevolgen van (recidiverende) PID kunnen zijn: chronische onderbuikspijn, verminderde vruchtbaarheid, onvruchtbaarheid en buitenbaarmoederlijke zwangerschap.19,20 Uiteindelijk kan opstijgende Ct-infectie verder uitbreiden naar het buikvlies (peritonitis) en andere organen. Onbehandelde urogenitale Ct-infectie tijdens de zwangerschap kan een verhoogd risico geven op voortijdige weeën, vroegtijdig gebroken vliezen, vroeggeboorte en een laag geboortegewicht.21,22,23 Tevens bestaat bij vrouwen na de bevalling een verhoogd risico op endometritis.
Mannen met een urogenitale Ct-infectie hebben vaker klachten dan vrouwen, maar ook bij mannen verloopt ongeveer 50% van de Ct-infecties asymptomatisch.18,24 Klachten bij mannen zijn een branderige mictie, vooral ’s ochtends waterige tot pusachtige afscheiding en soms pijn in de balzak (epididymitis). Opstijgende Ct-infectie bij mannen kan bij 1-4% leiden tot chronische prostatitis en/of epididymitis.25 Rectale Ct-infecties komen vaak voor, de betekenis hiervan is onduidelijk. Veelal verlopen de anale infecties asymptomatisch, hoewel anale infecties ook anorectaal ongemak veroorzaken en kunnen leiden tot proctocolitis. Wanneer een rectale Ct-PCR naast een urogenitale infectie voorkomt en behandeld wordt met eenmalig azitromycine, is er een gevaar van onderbehandeling en kunnen deze infecties bijdragen aan transmissie van Ct.26,27 Faryngeale Ct-infecties zijn meestal asymptomatisch, maar milde keelpijn kan voorkomen. Ct-infectie met urogenitale serotypen (D-K) kan ook bij volwassenen conjunctivitis veroorzaken en heeft een incubatieperiode van 4-12 dagen. Bij seksueel actieve volwassen gebeurt dit meestal via auto-inoculatie of via genito-oculair contact. Onbehandelde conjunctivitis kan chronisch worden en enkele maanden persisteren. Tekenen van Ct-conjunctivitis bij volwassenen zijn grote follikels in de onderste fornix en pre-auriculaire lymfadenopathie. Ook kan een chlamydia-infectie de oorzaak zijn van een perihepatitis (syndroom van Fitz-Hugh-Curtis).
Diagnostiek
Nucleïnezuurtechnieken (NAAT) zijn de meest gangbare diagnostische testen. De voordelen van deze technieken zijn de hogere sensitiviteit en specificiteit, ook op urine en bij cervix- en vagina-uitstrijkjes. Dit heeft als voordeel dat diagnostiek ook kan worden verricht op door de patiënt zelf afgenomen eerste straal urine bij mannen en diepvaginale uitstrijkjes bij vrouwen. Indien anamnestisch op grond van seksuele technieken of van klachten gedacht wordt aan een risico voor een chlamydia-infectie elders (rectum, conjunctiva, nasofarynx), moet ook van deze locatie een uitstrijkje worden gemaakt. Twee weken na infectie geven diagnostische NAAT’s een betrouwbaar resultaat. Indien een patiënt al behandeld is, is nacontrole binnen vier weken niet zinvol, omdat NAAT’s in deze periode positieve uitslagen kunnen geven ten gevolge van het nog aanwezige niet-levende materiaal.
Bij MSM hoort anale diagnostiek tot het standaardonderzoek. Testen en behandelen vindt plaats ter preventie van transmissie. Ook de kans op hiv-overdracht wordt vergroot indien gelijktijdig een andere soa aanwezig is. Dit is tevens een reden voor behandeling van anale infecties bij MSM.
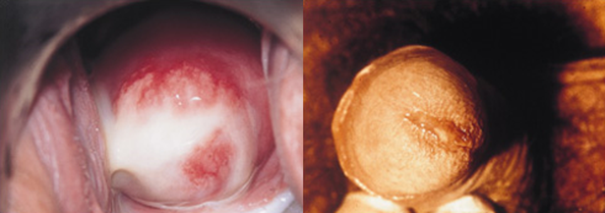
Figuur 3 Afscheiding door Chlamydia trachomatis.
Bron: Soa Aids Nederland
Behandeling
Tabel 3 Medicamenteuze behandeling van chlamydia.
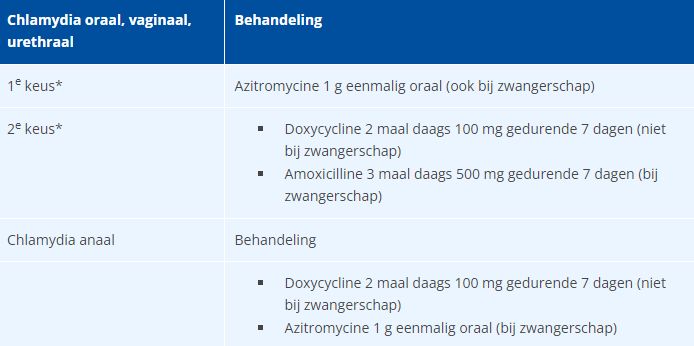
*Bij een ongecompliceerde chlamydia-infectie (zonder PID, epididymitis, (a)symptomatische proctitis of LGV).
Nazorg/monitoring
Bij recidief of (aanhouden van) klachten kan sprake zijn van een persisterende infectie of re-infectie door een onbehandelde of nieuwe partner. Voor alle bacteriële soa’s, dus ook voor Ct-infecties inclusief LGV, geldt dat de kans bestaat op een ‘pingpongeffect’. Bij recidief is het belangrijk om de anamnese goed uit te vragen en de therapie te evalueren om erachter te komen of het om een recidief gaat of om een onderbehandelde infectie. Het is niet altijd mogelijk onderscheid te maken tussen persistentie, resistentie of re-infectie. Nacontrole bestaat uit het herhalen van een Ct-NAAT-test van de eerder geïnfecteerde locatie. Normaal gesproken is nacontrole niet nodig, resistentie is zeldzaam. Behalve bij zwangeren en bij afwijkende therapiekeuze wordt nacontrole 3-6 weken na het afronden van de behandeling niet geadviseerd. Als klachten echter aanhouden, en bij twijfel over therapietrouw of als niet is behandeld met eerstekeusmiddelen azitromycine of doxycycline, is nacontrole wel geïndiceerd. Uit studies is gebleken dat in het bijzonder bij vrouwen veelvuldig re-infecties optreden, ook na adequate behandeling, contactopsporing en partnerwaarschuwing. Er zijn aanwijzingen dat het anale kanaal een reservoir kan vormen voor (asymptomatische) Ct-infecties. Auto-inoculatie van anaal naar vaginaal gebied zou hierbij een mogelijke verklaring kunnen zijn voor therapiefalen.
Lymphogranuloma venereum (LGV)
Anorectale LGV is een infectie van het proctum. De symptomen zijn anale afscheiding, pijn, jeuk, krampen, rectaal bloedverlies en obstipatie; veelal zonder lymfadenopathie in de liezen. Hoger gelegen infecties (proctocolitis) veroorzaken diarree en systemische klachten zoals koorts, gewichtsverlies en permanente complicaties zoals anale stricturen en fistels. Inguïnale LGV is een infectie van de uitwendige genitaliën met pijnlijk abcederende lymfeklierzwellingen (bubo’s) met of zonder afwijkingen van de porte d’entrée of urethritis. In Afrika komt deze ziekte zowel bij mannen als vrouwen voor, in de westerse wereld is LGV van de genitaliën zeer zeldzaam.
De uitbraak van anorectale LGV onder MSM in 2004, duurt voort. Er is nu sprake van endemische aanwezigheid van LGV in Nederland. Vooralsnog is geen sprake van verspreiding van LGV buiten de hoog-risicopopulatie MSM. Aan LGV dient te worden gedacht bij MSM met een genitaal ulcus, bubo’s of een bewezen anale chlamydia-infectie. Bij vrouwen is de anogenitale LGV-infectie uitzonderlijk en eenmaal beschreven.7
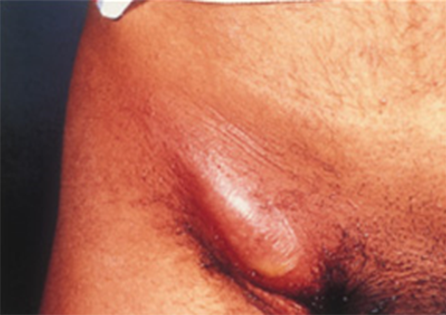
Figuur 4 Sterk gezwollen lymfeklier, bubo.
Bron: Soa Aids Nederland
Tabel 4 Medicamenteuze behandeling van LGV.

Gonorroe
De verwekker van gonorroe is de Neisseria gonorrhoeae (Ng), ook wel de gonokok genoemd. Deze seksueel overdraagbare aandoening staat ook bekend als druiper. Voordat antibiotica zijn intrede deed, was deze soa slecht behandelbaar. In het begin waren de gonokokken gevoelig voor diverse antibiotica. In toenemende mate trad echter hoge resistentie op.
Veroorzaker
De Ng-bacterie is een gramnegatieve diplokok. Gonokokken nemen hun intrek in de epitheelcellen van slijmvliezen waar ze mee in contact komen. Vervolgens vermenigvuldigen deze bacteriën zich intracellulair. In de submucosale weefsels komen na zo’n 2 tot 3 dagen de bacteriën vrij. Als gevolg hiervan kunnen kleine abcessen met exsudaat en pusvorming in de submucosa ontstaan. De bacterie kan zich in bepaalde gevallen direct of via de bloedbaan naar andere delen van het lichaam verplaatsen, om daar vervolgens complicaties te veroorzaken.
Epidemiologie
Het percentage personen met een gonorroe-infectie gediagnosticeerd door de CSG is in de periode 2011-2015 stabiel, behalve onder MSM waar de laatste jaren een toename wordt gezien. In 2015 werden er in de CSG 136.347 testen afgenomen, waarvan bij 17,2% minimaal één soa werd vastgesteld. In 2015 betrof dit voor gonorroe 5391 diagnosen. Deze soa werd het meest gediagnosticeerd bij MSM (10,7%).28 Het blijft belangrijk om te volgen of de gonorroe-bacterie resistent raakt tegen de antibiotica die in Nederland voorgeschreven worden, de zogenoemde derde generatie cefalosporines. In diverse Europese landen is deze resistentie al waargenomen.
Symptomen
Bij sommige vrouwen met urogenitale gonorroe treden amper of geen klachten op. Dit is bij zo’n 30-60% het geval. Indien er bij de vrouw wel symptomen ontstaan, dan is de voornaamste klacht meestal een toename van de hoeveelheid vaginale afscheiding. Overige klachten kunnen pijn, een branderig gevoel bij het plassen (dysurie), en tussentijds bloedverlies zijn. Bartholinitis en PID zijn mogelijke complicaties bij de vrouw. De meest voorkomende complicatie van onbehandelde urogenitale gonorroe is PID.Urethritis komt bij de man vaak voor. Enkele dagen na de overdracht treden meestal urethritisklachten op. De klachten variëren van pijn bij het plassen, branderigheid, en doorgaans afscheiding met pus. Deze afscheiding kan vrij beperkt zijn, maar ook heel hevig, vandaar de naam druiper.Bij de man kunnen complicaties optreden als prostatitis, epididymitis en, bij chronische urethrale infectie, urethrale stricturen. Ongeveer 10% van de urogenitale infecties bij de man verloopt asymptomatisch.24,29 Dit percentage kan bij rectale infecties oplopen tot 85%.24
Gonorroe kan oogklachten geven door middel van onder andere (auto-)inoculatie. Zowel bij mannen als bij vrouwen kunnen anale en faryngeale infecties voorkomen. Jeuk, irritatie en soms slijmerige afscheiding zijn klachten die kunnen optreden bij anale infectie. In het geval van een infectie van de keel is vaak sprake van weinig of geen uitgesproken klachten.30 Soms treedt purulente faryngitis op.31 Een enkele keer kan het voorkomen dat gonokokken in de bloedbaan terecht komen, dit kan zowel bij mannen als vrouwen gebeuren. Wanneer de gonokokken in de bloedbaan terecht komen (bacteriëmie) kan er een gegeneraliseerde infectie ontstaan. De gonokokken verplaatsen zich naar andere delen van het lichaam en brengen daar een ontsteking teweeg. Een voorbeeld hiervan is septische artritis. Een andere ernstige, maar zeldzame complicatie van gonorroe is perihepatitis (syndroom van Fitz-Hugh-Curtis), een ontsteking van het leverkapsel die voornamelijk bij vrouwen voorkomt. Deze complicatie gaat gepaard met pijn in de rechterbovenbuik, koorts en verhoogde leverenzymen in het bloed.
Diagnostiek
De eerste keus om urogenitale gonorroe bij de man uit te sluiten is door middel van de nucleïnezuuramplificatietest (NAAT) van de eerste straal. Een NAAT van een urethra-uitstrijk kan als mogelijk alternatief dienen. Een kweek van de urethra is de tweede keus. Bij een vrouw bestaat de eerste keus uit een NAAT van diep vaginaal afgenomen materiaal (zelfswab). Dit materiaal kan zowel door de vrouw zelf als door de onderzoeker worden afgenomen. Bij zowel mannen als vrouwen wordt bij blootstelling (passief anale en/of orale seks) en/of klachten een uitstrijk van de keel en/of proctum en/of conjunctiva voor een NAAT afgenomen. De behandeling van gonorroe kan in de toekomst mogelijk problematisch worden. Dit komt door de toenemende ongevoeligheid van N. gonorrhoeae voor de eerste keus antibiotica. Resistentiesurveillance is daarom van groot belang.
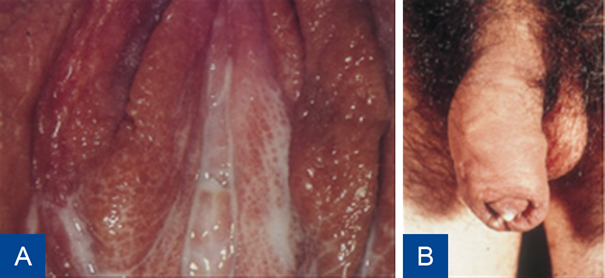
Figuur 5 Gonorroe bij vrouw (A) en man (B: druiper).
Bron: Soa Aids Nederland
Behandeling
Tabel 5 Medicamenteuze behandeling van gonorroe.

*Deze behandeling verdient niet de voorkeur aangezien deze hoge dosering vaak bijwerkingen geeft (waardoor het middel vaak ook niet binnengehouden wordt). Na orale behandeling met azitromycine is een controle door middel van NAAT/PCR (minimaal 4 tot 6 weken na behandeling) of kweek (minimaal 1 tot 2 dagen na beëindigen therapie) geïndiceerd, tenzij de kweekuitslag bekend is en is gebleken dat de bacterie gevoelig is voor azitromycine.
Nazorg/monitoring
Als algemene richtlijn geldt: vanaf 24 uur na het einde van de behandeling is een patiënt met gonorroe niet meer infectieus.
Herpes genitalis
In klassieke gevallen worden herpes genitalis en andere vormen van herpessimplexvirusinfectie gekenmerkt door typische in groepjes gelegen blaasjes. Deze blaasjes kunnen overgaan in pijnlijke erosies, mogelijk met korstvorming en/of pussig beslag. Het virus blijft niet-zichtbaar aanwezig, er treden geen laesies op. Het virus kan vooral lokaal vaak recidieven vertonen.
Veroorzaker
Herpessimplexvirussen zijn dubbelstrengs DNA-virussen die deel uitmaken van de familie van de herpesvirussen. Er zijn meer dan 100 herpesvirussen, waarvan er minimaal 9 bij de mens voor kunnen komen. Een bekend ziektebeeld is herpes labialis (koortslip) door herpes simplex type 1 (HSV-1, officieel HHV-1). Een ander ziektebeeld is herpes genitalis, veroorzaakt door zowel HSV-1 als HSV-2 (HHV-2).
Symptomen
De incubatieperiode van herpes genitalis bedraagt 2 tot 12 dagen. Er zijn een aantal factoren die de aard en ernst van de ziekteverschijnselen bepalen. Dit is onder andere afhankelijk van het type HSV, gastheerspecifieke factoren zoals lokalisatie, vroegere niet-genitale HSV-infectie, geslacht, immuunstatus van de persoon en of er sprake is van een primo-infectie of een recidief. Een primo-infectie verloopt meestal veel heftiger. Tussen herpes genitalis, veroorzaakt door HSV-1 en HSV-2, is geen verschil in ziekteverschijnselen.18
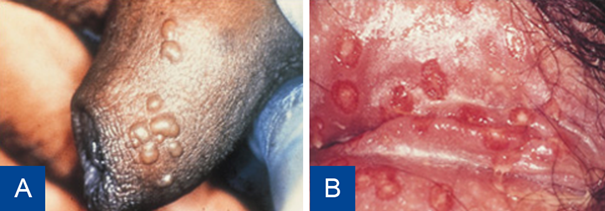
Figuur 6 Herpes genitalis.
A: Primaire infectie B: Primaire infectie op de labia/vulva.
Bron: Soa Aids Nederland
Volgens de literatuur verloopt de meerderheid van de genitale herpesinfecties asymptomatisch.
Tabel 6 Primo infect.
Complicaties van een genitale herpesinfectie zijn zeldzaam en treden vrijwel alleen op bij een primaire infectie met HSV-1 of HSV-2. Neonatale HSV-1- en HSV-2-infecties kunnen zeer ernstige symptomen geven. Bij moeders met recidiverende herpes genitalis (dus niet bij een primo infectie in het laatste trimester) is de kans op overdracht van herpes op de neonaat zeer gering, gezien de antistoffen die de moeder heeft gevormd: deze worden intra-uterien overgedragen aan de foetus.
Epidemiologie
Herpes genitalis komt overal in de wereld voor en is de belangrijkste ulceratieve soa in de westerse wereld met een geschatte prevalentie van 417 miljoen HSV-2-geïnfecteerden wereldwijd.37
Diagnostiek
Bij een typisch verlopende herpes genitalis-infectie kan met behulp van het klinische beeld en een goede (seksuele) anamnese een klinische diagnose worden gesteld. Het is niet goed mogelijk om een onderscheid te maken tussen een primo-infectie, of een heftig recidief. Dit komt omdat ook patiënten die een asymptomatische primo-infectie hebben doorgemaakt zich kunnen presenteren met een (ernstig) recidief. De blaasjes doorlopen diverse stadia. Wanneer een blaasje spontaan opengaat of er wordt aan gekrabd, kan het blaasje de vorm van een ulcus aannemen. Als de blaasinhoud vervolgens is opgedroogd, treedt het crusteuze stadium op. In dit stadium wordt weinig tot geen infectieus virus meer uitgescheiden. Daarna geneest de laesie meestal restloos. De totale duur varieert van 3 tot 7 dagen. De nucleïnezuuramplificatietest (NAAT) is de eerste keus voor het aantonen van het virus. Met behulp van een swab wordt langs de basis van een laesie of langs het vocht van een blaasje gegaan. Bij genitale herpes wordt deze techniek aanbevolen als diagnosticum.33
Behandeling
Zoals aangegeven blijft het herpesvirus altijd aanwezig, er is geen genezende therapie. Antivirale middelen beperken echter wel de duur en de ernst van de ziekteverschijnselen, evenals de duur van de uitscheiding van het virus. Overweeg daarom bij frequente recidieven (> 6 per jaar) met veel klachten profylaxe met valaciclovir 1 maal daags 500 mg. Evalueer na 6 tot 12 maanden en overweeg dan samen met de patiënt om de medicatie op proef te staken. Hervat de medicatie bij frequente recidieven na staken (blijkend uit ten minste twee episoden in korte tijd) en evalueer vervolgens jaarlijks.
Tabel 7 Medicamenteuze behandeling van herpes genitalis.

Behandeling bij zwangerschap
Bij de zwangere vrouw dient een NAAT van materiaal van een verdachte laesie te worden verricht als er tijdens de zwangerschap of baring verdenking is op (een) primo-infectie met herpes genitalis. Zwangere vrouwen met een, al dan niet primaire, herpes genitalis die veel klachten veroorzaakt, kunnen met aciclovir, valaciclovir en famciclovir behandeld worden, onafhankelijk van de duur van de zwangerschap.Neonaten met een symptomatische herpessimplexinfectie, een significante klinische verdenking op een HSV-infectie en/of met een positieve kweek of NAAT moeten direct behandeld worden met (i.v.) aciclovir door de kinderarts.
Tabel 8 Medicamenteuze behandeling van herpes genitalis bij zwangeren.

Scabiës
Scabiës (schurft) is een huidinfectie die wordt veroorzaakt door Sarcoptes scabiei. Jeuk is de voornaamste klacht van scabiës.
Veroorzaker
Bij mensen wordt scabiës veroorzaakt door de Sarcoptes scabiei var hominis. Deze mijt heeft acht poten en een ovaal lichaam met een platte onder- en bovenkant. De borstels en stekels op de rug (denticuli) dienen voor het graven van een gangetje in de opperhuid van de mens. Het gangetje wordt uitsluitend gegraven door een volwassen vrouwtje en bevindt tussen het stratum corneum (hoornlaag) en stratum granulosum (korellaag) van de huid. Met behulp van een secreet dat lysis (oplossing van celmateriaal) van de oppervlakkige cellen veroorzaakt, graaft een vrouwtje 0,5 tot 5 mm per dag. Een gangetje wordt maximaal 15 mm lang.
Het voedsel van het vrouwtje bestaat uit het product van de lysis. Copulatie vindt plaats in het gangetje, waarna het mannetje sterft. Het vrouwtje legt vervolgens 2-4 eitjes per dag gedurende de rest van haar 4-6 weken durende leven. In totaal legt ze zo’n 40-60 eitjes. Na 2-7 dagen kruipt er uit het ei een zespotige larve, die naar het huidoppervlak gaat en vervolgens op de huid leeft. De larve voedt zich en vervelt door kleine gaatjes in haarfollikels of huidplooien te maken. Vervolgens komt hij in de achtpotige nymfefase. Het mannetje ontwikkelt zich, na enkele vervellingen, in zo’n 9-10 dagen tot een geslachtsrijpe mijt. Het vrouwtje heeft hiervoor zo’n 12-15 dagen nodig. In alle ontwikkelstadia lopen de mijten over het menselijk lichaam. De uitzondering hierop is het vrouwtje in het legstadium.34
Epidemiologie
In de Nederlandse huisartsenpraktijk was de incidentie van ‘scabiës en aandoeningen door andere mijten’ in 2014 ongeveer 1 per 1000 persoonsjaren.35 Scabiësuitbraken komen met regelmaat voor in instellingen en situaties waar verschillende personen dicht bij elkaar verblijven.
Symptomen
Toenemende jeuk is een van de belangrijkste symptomen van scabiës, met name wanneer een patiënt dat eerder niet had en als mensen in de omgeving ook jeukende huiduitslag hebben. Jeuk vindt niet alleen plaats op de plekken waar de mijten zitten. Er kan ook een meer algemene jeukende uitslag voorkomen, die vaak verspreid over het hele lichaam is en die niet samenhangt met de locatie of het aantal mijten.
Diagnostiek
Een ervaren dermatoloog is vaak nodig om een mijt te lokaliseren. Met behulp van een lancetmesje (no.15) kan bij een gangetje een oppervlakkig stukje opperhuid worden weggeschraapt. Dit kan vervolgens onder een objectglaasje worden gelegd, verweekt in een KOH-oplossing en onder een dekglaasje. Op deze manier kan er een direct preparaat worden gemaakt. Scabies crustosa daarentegen is een stuk eenvoudiger aan te tonen onder de microscoop. De mijten zijn te vinden in bijna elke huidschilfer. Deze aandoening is een indicatie voor verwijzing naar een dermatoloog (na voorafgaand overleg, gezien het infectiegevaar).
Behandeling
De behandeling van gewone scabiës bestaat uit:
In volgorde van voorkeur bestaat de behandeling uit:
-
Permetrinecrème 5% , eenmalig aanbrengen overnacht, over het gehele lichaam tot de kaakrand. Bij kinderen en oudere patiënten kan de crème ook op het gezicht, de oren en de hoofdhuid worden aangebracht. Patiënten dienen in dat geval de crème niet te dicht rond de ogen en mond te smeren . Speciale aandacht dient uit te gaan naar de plaatsen tussen de vingers en tenen, polsen, oksels, uitwendige mannelijke genitaliën, billen en onder de nagels van vingers en tenen. De inwerkingstijd van de crème bedraagt 8-12 uur. Daarna dient het gehele lichaam grondig gewassen te worden
-
Recept ivermectine 200 μg/kg lichaamsgewicht. Eenmalig aanbrengen, herhalen na 2 weken
Syfilis
Veroorzaker
De verwekker van syfilis is Treponema pallidum. De T. pallidum is een obligaat menselijk pathogeen dat anaeroob groeit. Wanneer een persoon wordt besmet met T. pallidum leidt dat tot een bepaalde mate van immuniteit, dit is echter niet afdoende om een herinfectie te voorkomen.
Epidemiologie
Syfilis komt over de hele wereld voor. De incidentie van syfilis is 6 miljoen nieuwe infecties per jaar.37 Syfilis is nog altijd een belangrijke oorzaak van genitale ulcera, met name in ontwikkelingslanden. Vroeger kwam het voornamelijk voor in Sub-Sahara-Afrika, waar bij zwangere vrouwen incidenties tussen 4 en 15% voorkwamen. Herpes simplex wordt hier, sinds de hiv-epidemie, vaker dan syfilis aangetroffen als oorzaak voor genitale ulcera. Na een daling in syfilis is er de laatste jaren weer een stijgende trend, hoofdzakelijk onder MSM.38
Symptomen
Syfilis is een ziekte met een zeer wisselend klinisch beloop. De ziekte wordt wel the great imitator genoemd omdat de diverse klinische manifestaties van syfilis overeenkomen met andere ziektebeelden. In het klinische beloop van syfilis valt een onderscheid te maken in primaire, secundaire, latente en tertiaire syfilis.
-
In het geval van primaire syfilis is er een primaire laesie die in het begin het aspect heeft van een stug aanvoelende papel. Deze papel gaat vervolgens na enkele dagen in het centrum kapot waarna het overgaat in een stevig aanvoelend meestal pijnloos ulcus (ulcus durum). De verspreiding van spirocheten vindt binnen enkele uren plaats via lymfe- en bloedvaten. Om deze reden moet syfilis van begin af aan als een systemische infectie worden beschouwd. Elk orgaan kan geïnfecteerd raken door de bacterie, waaronder het centraal zenuwstelsel
-
De verschijnselen van secundaire syfilistreden tussen de 6 en 12 weken op na het contact. In vrijwel alle organen kan Treponema dan worden ontdekt. In deze periode zijn ook de slijmvlieslaesies infectieus. Vasculaire veranderingen spelen een grote rol bij secundaire syfilis. Daarnaast treden ook histologische veranderingen op in de dermis en epidermis
-
Na tientallen jaren treedt progressie naar tertiaire syfilis op. Dit is vermoedelijk een reactie op de afname van de immuunrespons. Treponema’s dringen het centrale zenuwstelsel (neurosyfilis), de huid, cardiovasculaire structuren en andere organen binnen
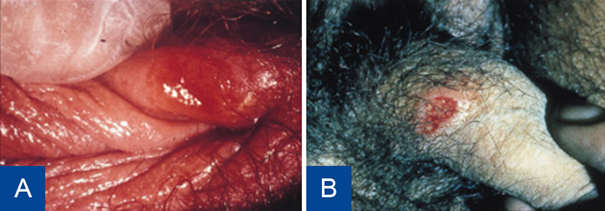
Figuur 7 Syfilis, primair affect op labium major (A). Syfilis, primair affect op de penis (B). Bron: Soa Aids Nederland
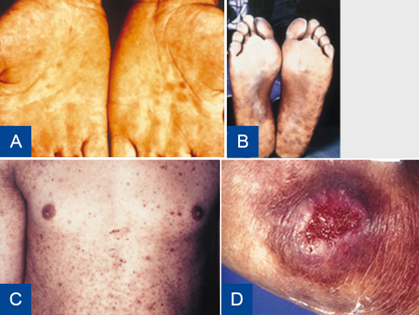
Figuur 8 Syfilis stadium II en stadium III.
A: Roseolen op handpalmen, syfilis stadium II, B: Roseolen op voetzolen, syfilis stadium II, C: Syfilitisch exantheem op romp, syfilis stadium II, D: Gumma (necrotisch granuloom), syfilis stadium III.
Bron: Soa Aids Nederland
Diagnostiek
In de klassieke presentatie is het ulcus durum weinig pijnlijk en komt bij externe druk wondexsudaat (prikkelserum) vrij dat geschikt is voor donkerveldmicroscopie, zie figuur 9.
Tabel 9 Diagnostiek van syfilis.

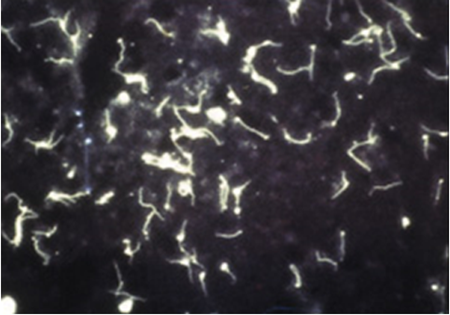
Figuur 9 Treponema pallidum (donkerveldmicroscopie).
Bron: Soa Aids Nederland
Het advies aan de huisarts is om bij een patiënt met syfilis ervoor te kiezen om te verwijzen naar een soa-polikliniek of naar een dermatoloog voor behandeling. Eventueel kan de (hierin ervaren) huisarts ook zelf behandelen. Verwijs patiënten die syfilis langer dan een jaar geleden hebben opgelopen evenals zwangeren en patiënten met een hiv co-infectie altijd voor behandeling naar de soa-poli of dermatoloog en internist. Denk ook aan serologische controle en aan partnerwaarschuwing. Schakel zo nodig de GGD in.
Behandeling
Tabel 10 Medicamenteuze behandeling van primaire of secundaire syfilis (facultatief om dit zelf te behandelen).

Nazorg/monitoring
Na de behandeling dient klinische en serologische herevaluatie plaats te vinden. Bij de klinische herevaluatie zijn vooral huidafwijkingen en neurologische syndromen belangrijk. De herbeoordeling dient bij vroege vormen van syfilis (syfilis 1, 2 en recent latente stadia)na 6 en 12 maanden te gebeuren.Er is mogelijk sprake van therapiefalen of herinfectie bij aanhoudende/recidiverende klinische symptomen of een viervoudige toename in de niet-treponemale testtitel (vergeleken met de waarde aan het begin van de behandeling). Deze patiënten dienen te worden verwezen naar de dermatoloog.
Trichomoniasis
Veroorzaker
De Trichomonas vaginalis-parasiet is een geflagelleerd protozoön, dat gedurende jaren asymptomatische vaginitis kan veroorzaken. Seksueel contact is de oorzaak van de infectie.
Epidemiologie
Vaginale klachten komen voor met een frequentie van ongeveer 29 gevallen per 1.000 vrouwen. Bij ongeveer twee derde van alle vaginale klachten is een vaginitis of vaginose de oorzaak, in enkele gevallen speelt een Trichomonas vaginalis hierbij een rol.18
Symptomen
Klassieke kenmerken: jeuk, geel (bruin)groene fluor met vele gasbelletjes, een onaangename (amine) geur, branderig gevoel in de vagina, een duidelijke vulvitis en vaginitis (soms met een ‘aardbei’-aspect van de vagina en cervix), pH > 4,5 en leukocytose.
Diagnostiek
De diagnose is zeker bij bewegende, geflagelleerde protozoa in het fysiologisch-zoutpreparaat of een positieve kweek of NAAT. Soms komt een T. vaginalis-infectie ook aan het licht door verrichte cervixcytologie. Aangezien dit een weinig specifieke bevinding is, dient een kweek of NAAT te worden verricht ter bevestiging van de diagnose.39,40 Infectie met T. vaginalis wordt in sommige klinieken gediagnostiseerd door NAAT-diagnostiek en in andere uit een specifieke T. vaginalis-kweek.
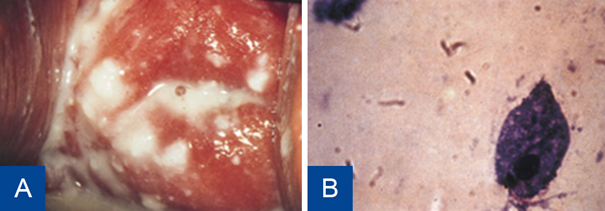
Figuur 10 Trichomonas vaginalis.
A: Trichomonas vaginalis (wit, schuimend).B: Microscopisch beeld Trichomonas vaginalis.
Bron: Soa Aids Nederland
Behandeling
Tabel 11 Medicamenteuze behandeling van trichomoniasis.

Casuïstiek
1
Casus I – 24-jarige man met pijnlijk gevoel in penis
Casus II – 26-jarige man met wratten op billen
Casus III – 25-jarige vrouw met vage buikklachten
Casus IV – 30-jarige man met geïrriteerd plekje op penis
1.1
Wim, 30 jaar, komt op het spreekuur met de klacht dat hij sinds enige dagen een pijnlijk geïrriteerd plekje op zijn penis heeft. Bij onderzoek vindt de huisarts een erosie met enige blaasjes op de voorhuid, die sinds enige dagen bestaan. Zij stelt de diagnose infectie herpes genitalis. Wim heeft dit nog nooit eerder gehad. Hij heeft geen algemene symptomen zoals koorts en de inguinale lymfeklieren zijn niet opgezet. Het betreft hier een eerste uiting van een HSV-infectie, maar mogelijk/waarschijnlijk geen primo-infectie.
1. Wat is uw eventuele medicamenteuze beleid?
Controleer uw antwoord

Een indifferent smeersel, bijvoorbeeld zinkoxidesmeersel FNA, eventueel gecombineerd gebruikt of afgewisseld met lidocaïne vaselinecrème. Bij een eerste infectie met veel klachten geeft u valaciclovir tweemaal daags 500 mg gedurende vijf tot tien dagen of famciclovir driemaal daags 250 mg gedurende vijf dagen of eventueel aciclovir 200 mg vijfmaal daags één tablet, hoewel therapietrouw bij 5x per dag doseren afneemt. Deze geneesmiddelen geven alle een significante vermindering van klachten, de laesies zijn eerder verdwenen.
1.2
2. Verandert uw beleid als Wim met een recidief komt?
Controleer uw antwoord

Recidieven verlopen meestal minder ernstig en kunnen eventueel behandeld worden met indifferente smeersels, of met lidocaïne vaselinecrème. Bij ernstig recidief wordt de episodebehandeling overwogen. De patiënt dient dan bij de eerste symptomen te beginnen en heeft dus tijdig een recept nodig. Bij meer dan zes recidieven per jaar en bij immuunsuppressie dient volgens de NHG-Standaard Het soa-consult recidiefprofylaxe overwogen te worden met zes tot twaalf maanden 1 dd 500 mg valaciclovir, 2 dd 250 mg famciclovir of 2 dd 400 mg aciclovir. Beoordeel na deze periode of het natuurlijk beloop gunstiger is en geen profylaxe meer nodig is. Hervat indien nodig de medicatie. Er is hier geen plaats voor aciclovircrème.






















